
科目: 来源: 题型:选择题
| A. | 用石墨作电极电解饱和食盐水时,若阴极得到2 NA个电子,则阳极产生22.4 L气体 | |
| B. | 2 L 0.05 mol•L-1乙酸溶液中H+数目为0.1 NA | |
| C. | 足量的Cu与含有0.2 mol H2SO4的浓硫酸共热可生成SO2为0.1 NA | |
| D. | 7.8 g Na2S 和Na2O2的混合物中,含有的阴离子数目为0.1 NA |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 步骤一用到的仪器有坩埚、三脚架和泥三角 | |
| B. | 步骤二添加NaOH的目的是除去Ca2+ | |
| C. | 步骤二的过滤操作是在加入盐酸之后 | |
| D. | 步骤三最后一步反应为2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 自然界化合态硫主要以硫铁矿、黄铜矿、石膏、芒硝等形式存在 | |
| B. | 火法炼铜的矿石原料主要含CuS | |
| C. | 该公司炼铜产生的SO2可用于生产H2SO4 | |
| D. | 常温下,18.4 mol/L H2SO4溶液可储存于铁制或铝制容器 |
查看答案和解析>>
科目: 来源: 题型:选择题
 X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期.下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物.下列分析正确的是( )
X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期.下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物.下列分析正确的是( )| A. | 离子半径:Y>Z | B. | Z的含氧酸均有强氧化性 | ||
| C. | 与Y同周期氢化物中D最稳定 | D. | F含离子键和共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CSO的电子式: | |
| B. | Cl-的结构示意图: | |
| C. | 原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl | |
| D. | 苯分子的球棍模型: |
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )
常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)>c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
 据图回答下列问题:
据图回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该检测仪利用了电解原理 | |
| B. | 质子交换膜具有类似盐桥的平衡电荷作用 | |
| C. | Pt(l)极反应为:CH3CH2OH-4e-+H2O=4H++CH3COOH | |
| D. | 工作中电子由Pt(l)电极经过质子交换膜流向Pt(II) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在25℃、1.01×105 Pa时,11.2 L氮气所含的原子数目为NA | |
| B. | 常温下,1 L 0.1 mol/L的Na2CO3溶液中含有的离子总数为0.3 NA | |
| C. | 钠在空气中燃烧可生成多种氧化物,23 g钠充分燃烧时转移电子数为1 NA | |
| D. | 1 mol P4和1 mol CH4中含有的共价健数均为4 NA |
查看答案和解析>>
科目: 来源: 题型:推断题

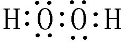 ,用电子式表示Y的形成过程
,用电子式表示Y的形成过程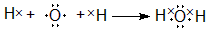 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com