
科目: 来源: 题型:选择题
| 选项 | 异常情况 | 可能的原因 |
| A | 蒸发结晶时,蒸发皿破裂 | 将溶液蒸干了 |
| B | 分液时,分液漏斗中的液体难以滴下 | 没有打开分液漏斗颈上的玻璃塞上 |
| C | 萃取时,振荡溶液,静置不分层 | 萃取剂加的太多 |
| D | 蒸馏时,液体暴沸 | 没有添加沸石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 平衡时N2的转化率:α甲>2α乙 | B. | 平衡时NH3的浓度:2c甲<c乙 | ||
| C. | 平衡时体系压强:2p甲>p乙 | D. | 反应放出的热量:2Q甲>Q乙 |
查看答案和解析>>
科目: 来源: 题型:选择题
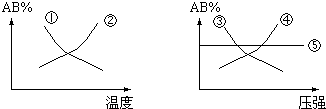
| A. | ①② | B. | ③④ | C. | ① | D. | ①⑤ |
查看答案和解析>>
科目: 来源: 题型:解答题
 ),已知有关物质的沸点如表:
),已知有关物质的沸点如表:| 物质 | 异丙醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 82.4 | 249 | 218 |
 .
.
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 图一:引发铝热反应的操作是点燃镁条 | |
| B. | 图二:可用于化学反应速率的测定 | |
| C. | 图三:滴加K3[Fe(CN)6]溶液,产生特征蓝色沉淀 | |
| D. | 图四:酸式滴定管注入Na2CO3溶液之前应检查是否漏液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+═SO42-+3S↓+H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ | |
| C. | 盐碱地(含较多NaCl、Na2CO3)中加入石膏,降低土壤的碱性,涉及的方程式为:Ca2++CO32-═CaCO3↓ | |
| D. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com