
科目: 来源: 题型:选择题
 茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素的有关叙述正确的是( )
茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素的有关叙述正确的是( )| A. | 分子式为C15H13O7 | |
| B. | 1 mol儿茶素A在一定条件下最多能与7molH2加成 | |
| C. | 等质量的儿茶素A分别与足量的金属钠和氢氧化钠反应,消耗金属钠和氢氧化钠的物质的量之比为1:1 | |
| D. | 1 mol儿茶素A与足量的浓溴水反应,最多消耗Br24 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
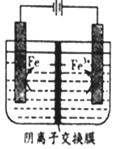
| A. | .阳极主要发生反应:Fe2+-e-═Fe3+ | |
| B. | 可用高纯铁电极作阴扱 | |
| C. | .电解液中的SO42-由右向左通过阴离子交换膜 | |
| D. | .电解法制备髙纯铁总反应:3Fe2+$\frac{\underline{\;通电\;}}{\;}$Fe+2Fe3+ |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 原溶液中一定不存在Ag+、Al3+、Ba2+、SO42- | |
| B. | 实验中生成沉淀的离子方程式是SiO32-+2H+=H2SiO3↓ | |
| C. | 原溶液一定存在K+、CO32-,可能存在NO3- | |
| D. | 原溶液不存在NO3-时,c(K+)=0.8mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:实验题

| 步骤 | 操作 | 结论 |
| 1 | 将1.6g固体产物溶于过量稀硫酸 | 假设一成立 |
| 2 | 往步骤1所得溶液中先加入足量双氧水,再加入足量NaOH溶液并充分搅拌 | |
| 3 | 过滤、洗涤、干燥灼烧至恒重 | |
| 4 | 称得最终固体质量为1.6g |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:实验题
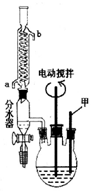 苯甲酸(C6H5COOH式量:122,熔点122.4℃,密度为1.2659g•cm-3)是一种一元有机弱酸,微溶于水易溶于乙醇.实验室中由甲苯(式量:92,密度为0.8669g•cm-3)制备苯甲酸的实验如下:
苯甲酸(C6H5COOH式量:122,熔点122.4℃,密度为1.2659g•cm-3)是一种一元有机弱酸,微溶于水易溶于乙醇.实验室中由甲苯(式量:92,密度为0.8669g•cm-3)制备苯甲酸的实验如下:查看答案和解析>>
科目: 来源: 题型:解答题
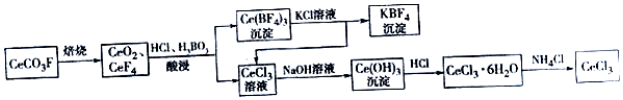
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2含量增加会导致温室效应 | |
| B. | 为减少木材的使用,使用聚氯乙烯生产包装盒 | |
| C. | 装修材料中的甲醛、芳香烃等会造成污染 | |
| D. | 天然气代替煤作燃料可减少环境污染 |
查看答案和解析>>
科目: 来源: 题型:选择题
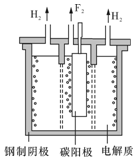
 在通电条件下,用如图所示装置由乙二醛(OHC-CHO)反应制备乙二酸(HOOC-COOH).其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl.下列说法正确的是( )
在通电条件下,用如图所示装置由乙二醛(OHC-CHO)反应制备乙二酸(HOOC-COOH).其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl.下列说法正确的是( )| A. | 每消耗0.lmol乙二醛,在Pt1极放出2.24L气体(标准状况) | |
| B. | Pt1的电极反应为:4OH--4e-=2H2O+O2↑ | |
| C. | 每得到1mol乙二酸将有2molH+从右室迁移到左室 | |
| D. | 盐酸是起提供Cl-和增强导电性的作用 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=-1560.8 kJ/mol | |
| B. | 稳定性:正丁烷>异丁烷 | |
| C. | 正戊烷的燃烧热大于3531.3kJ/mol | |
| D. | 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com