
科目: 来源: 题型:选择题
| A. | 燃料不完全燃烧排放的CO是大气污染物之一 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 将已成熟的水果放入未成熟的水果中并密封,可加速水果成熟 | |
| D. | 医用消毒酒精中乙醇的浓度(体积分数)为95% |
查看答案和解析>>
科目: 来源: 题型:选择题
 化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层.某化学镀铜的反应速率随镀液 pH 变化如图所示.(已知:该镀铜过程中,镀液 pH 控制在 12.5 左右).根据图中信息,下列说法正确的是( )
化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层.某化学镀铜的反应速率随镀液 pH 变化如图所示.(已知:该镀铜过程中,镀液 pH 控制在 12.5 左右).根据图中信息,下列说法正确的是( )| A. | 若采用电镀的方法,镀件应与电源正极连接 | |
| B. | 若用铜盐进行化学镀铜,镀件做氧化剂 | |
| C. | 可以调节溶液的 pH 至 8-9 之间使反应停止 | |
| D. | 同等条件下,使用化学镀比电镀反应速率更快 |
查看答案和解析>>
科目: 来源: 题型:选择题
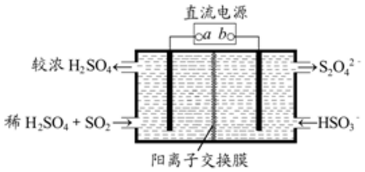 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液可吸收NO2.下列说法正确的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液可吸收NO2.下列说法正确的是( )| A. | a为直流电源的负极 | |
| B. | 与 b电极相连的电极反应式为:2HSO3-+2H++2e-═S2O42-+2H2O | |
| C. | 与 a相连的电极发生还原反应得到SO42- | |
| D. | 电解时,H+由阴极室通过阳离子交换膜到阳极室 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | -个苯环上已经连有-CH3、-CH2CH3、-OH三种基团,如果在苯环上再连接一个-CH3,其同分异构体有16种 | |
| B. | 裂化汽油可用于萃取溴水中的溴 | |
| C. | 除去乙醇中的少量水,方法是加入新制生石灰,经过滤后即得乙醇 | |
| D. | 除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验操作和现象 | 实验结论 | |
| A | 分别向2mL 0.1mol•L-1 CH3COOH溶液和2mL 0.1mol•L-1H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 用3mL稀盐酸与过量Zn反应,当气泡稀少时,加入1mL 浓盐酸,又迅速产生较多气泡 | 盐酸浓度增大,反应速率加快 |
| C | 向少量无水乙醇中加入一小粒金属Na,生成可燃性气体 | CH3CH2OH是弱电解质 |
| D | 向2mL 0.1mol•L-1 NaOH溶液中滴加3滴0.1mol•L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol•L-1 FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
 室温时,将0.10mol/L NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积的变化曲线如图.当V(NaOH)=20.00mL,二者恰好完全反应.则下列有关说法不正确的是( )
室温时,将0.10mol/L NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积的变化曲线如图.当V(NaOH)=20.00mL,二者恰好完全反应.则下列有关说法不正确的是( )| A. | 该一元酸溶液浓度为0.10 mol•L-1 | |
| B. | a、b、c点的水溶液导电性依次增强 | |
| C. | 室温时,HA的电离常数Ka≈l×10-5 | |
| D. | a点和c点所示溶液中H2O的电离程度相同 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通常状况下,苯是无色、有特殊气味的液体,燃烧时可产生浓烟 | |
| B. | 通常状况下,苯与浓硝酸混合则剧烈反应生成硝基苯,苯不能使酸性KMnO4溶液褪色 | |
| C. | 苯和乙醇可以通过直接蒸馏进行分离 | |
| D. | 苯有一种二氯代物 |
查看答案和解析>>
科目: 来源: 题型:解答题
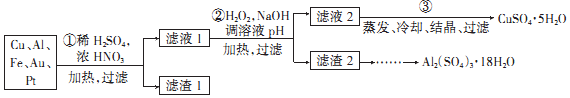
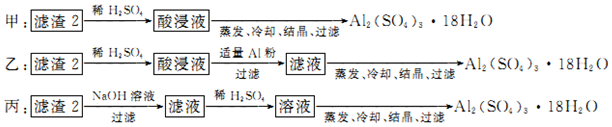
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com