
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | X(g)+Y(g)?Z(g)+W(s)△H>0,升高温度,该反应的△H增大 | |
| C. | 已知:S(s)+O2(g)═SO2(g)△H1,S(g)+O2(g)═SO2(g)△H2 则△H1>△H2 | |
| D. | 甲中加入1 g SO2、1 g O2,乙中加入2 g SO2、2 g O2,在恒温恒容或恒温恒压下反应2SO2(g)+O2(g)?2SO3(g)达平衡时,乙放出的热量都等于甲的2倍 |
查看答案和解析>>
科目: 来源: 题型:实验题
 煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等质量的CO、N2含有的分子数均为NA | |
| B. | 0.5 mol/L的MgCl2溶液中Cl-离子的物质的量为NA | |
| C. | 常温常压时,4.48 L CH4气体中含有的原子数大于NA | |
| D. | 12克13C含有的碳原子数小于NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:X>Y>W>Z | B. | 离子半径:Z3->W->Y+>X2+ | ||
| C. | 原子序数:d>c>b>a | D. | 原子的最外层电子数目:X>Y>W>Z |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 撤离污染区人员至安全地带,防止苯蒸气对人体造成危害 | |
| B. | 切断电源,因为苯是一种易挥发、易燃物质,否则可能引起爆炸 | |
| C. | 采用活性炭吸附地面液体 | |
| D. | 由于现场比较空旷,采用点火焚烧的办法清除泄漏物 |
查看答案和解析>>
科目: 来源: 题型:解答题
 (乙基苄基醚),采用如下两条路线进行对比:
(乙基苄基醚),采用如下两条路线进行对比:
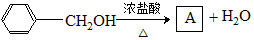


 、C2H5-O-C2H5.
、C2H5-O-C2H5. .
. +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl,②2C2H5OH+2Na→2C2H5ONa+H2↑,③
+HCl,②2C2H5OH+2Na→2C2H5ONa+H2↑,③ +C2H5ONa→
+C2H5ONa→ +NaCl.
+NaCl.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7 | |
| B. | 钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能 | |
| C. | 高氯酸的酸性与氧化性均大于次氯酸的酸性和氧化性 | |
| D. | 邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点 |
查看答案和解析>>
科目: 来源: 题型:多选题
 )可作为合成青蒿素的中间体,关于香茅醛的叙述正确的有( )
)可作为合成青蒿素的中间体,关于香茅醛的叙述正确的有( )| A. | 分子式为C10H18O | B. | 不能发生银镜反应 | ||
| C. | 可使酸性KMnO4溶液褪色 | D. | 分子中有7种不同化学环境的氢 |
查看答案和解析>>
科目: 来源: 题型:推断题

 ,反应②的反应类型为消去反应.
,反应②的反应类型为消去反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com