
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
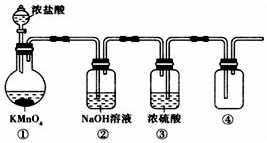 高锰酸钾(KMnO4)与浓盐酸不需加热就能发生反应产生Cl2.若用如图所示的实验装置制备纯净、干燥的Cl2,其中有错误的装置是( )
高锰酸钾(KMnO4)与浓盐酸不需加热就能发生反应产生Cl2.若用如图所示的实验装置制备纯净、干燥的Cl2,其中有错误的装置是( )| A. | ①② | B. | ② | C. | ②③ | D. | ②③④ |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 和金属钠反应键①断裂 | |
| B. | 在铜催化下和O2反应键①③断裂 | |
| C. | 乙醇与金属钠反应比水与金属钠反应缓慢 | |
| D. | 钠与乙醇反应时,钠熔化成一个小球在乙醇表面不断的游动 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 卤代烃的消去反应比水解反应更容易进行 | |
| B. | 在溴乙烷中加入过量NaOH溶液,充分振荡,然后加入几滴AgNO3溶液,出现黄色沉淀 | |
| C. | 消去反应是引入碳碳双键的唯一途径 | |
| D. | 在溴乙烷与NaCN、CH3C≡CNa的反应中,都是其中的有机基团取代溴原子的位置 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入足量的新制氯水,溶液变色则有Br- | |
| B. | 加入酸性KMnO4溶液,观察溶液颜色是否褪去 | |
| C. | 加入硝酸银溶液,再加稀硝酸,若有浅黄色沉淀则有Br- | |
| D. | 加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 150 mL 2 mol•L-1盐酸 | B. | 500 mL2mol•L-1硫酸 | ||
| C. | 50 mL 3 mol•L-1盐酸 | D. | 50 mL 18.4 mol•L-1硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com