
科目: 来源: 题型:解答题
 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
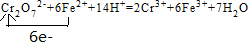 .
.查看答案和解析>>
科目: 来源: 题型:推断题
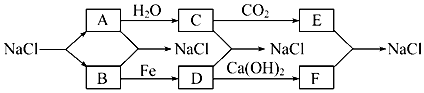
查看答案和解析>>
科目: 来源: 题型:计算题
 在1L密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.
在1L密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目: 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | 放热1940kJ | B. | 吸热1940kJ | C. | 放热485kJ | D. | 吸热485kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
 某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器.他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置.通电数分钟后,果真制得了消毒液.他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是( )
某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器.他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置.通电数分钟后,果真制得了消毒液.他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是( )| A. | a为正极,b为负极;NaClO和NaCl | B. | a为负极,b为正极;NaClO和NaCl | ||
| C. | a为阳极,b为阴极;HClO和NaCl | D. | a为阴极,b为阳极;HClO和NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com