
科目: 来源: 题型:选择题
| A. | 当2a=b时,溶液中生成的沉淀质量最大 | |
| B. | 当a=2b时,发生的离子反应为2NH4++SO42-+Ba2++2OH-═BaSO4↓+2NH3•H2O | |
| C. | 当2b≤3a时,发生的离子反应为3SO42-+2Al3++3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 当2a<b≤2.5a时,溶液中的n(AlO2-)为0.02(b-2a) mol |
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LH2X溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列说法不正确的是( )
常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LH2X溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列说法不正确的是( )| A. | 水电离出来的c(OH-):D点>B点 | |
| B. | C点存在关系式:c(Na+)=c(HX-)+c(X2-)-c(H+) | |
| C. | B点:c(HX-)>c(H+)>c(X2-)>c(H2X) | |
| D. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}X)}$增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 阳极的电极反应式:4OH--4e-═O2↑+2H2O | |
| B. | 若将阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,同样可制得纯净物的H3PO2 | |
| C. | H3PO2分子中P元素的化合价为+1价 | |
| D. | 阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.| 物质 | 电离常数(Ka) |
| HCN | Ka=5×10-10 |
| H2CO3 | Ka1=4.5×10-7 Ka2=4.7×10-11 |

查看答案和解析>>
科目: 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |

查看答案和解析>>
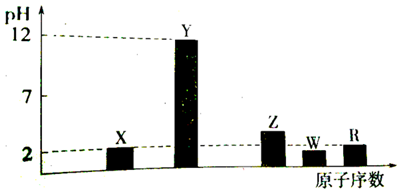
科目: 来源: 题型:选择题
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与其他元素生成的化合物都是离子化合物 | |
| D. | b、c、d与氢形成的化合物中化学键均为极性共价键 |
查看答案和解析>>
科目: 来源: 题型:解答题
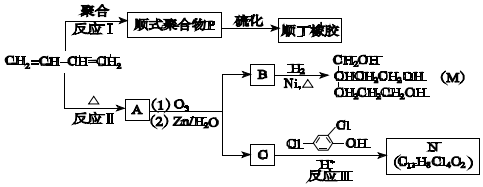
 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$
 ;
;


 .
.查看答案和解析>>
科目: 来源: 题型:解答题
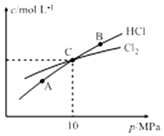 氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.
氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂. .
.| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| B. | c(A-)+c(HA)=2c (Na+)=0.4 mol/L | |
| C. | HA溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$与上述混合溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$相等 | |
| D. | c(A-)-c(HA)=2 c (H+)-c (OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com