17.(NH
4)
2SO
4是常见的化肥和化工原料,受热易分解.某兴趣小组拟探究(NH
4)
2SO
4受热分解产物.
[查阅资料](NH
4)
2SO
4在260℃和400℃时分解产物不同.
[实验探究]该小组拟选用图1所示装置进行实验(夹持和加热装置略)
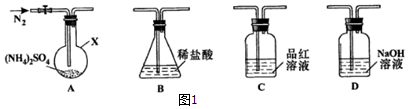
实验1:连接装置A-B-C-D,检査气密性,A中加入0.03mol (NH
4)
2SO
4,装置B盛0.5000mol/L盐酸70.00mL.先通入N
2排尽空气后,关闭活塞K,于260℃加热装置A 一段时间,停止加热,冷却,打开活塞K继续通N
2一段时间,品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00Ml.经检验滴定后的溶液中无SO
42-,装置A中(NH
4)
2SO
4完全分解后有固体剩余.
(1)装置B的作用是吸收NH
3(填化学式);已知260℃(NH
4)
2SO
4加热完全分解的产物只有两种,结合题中数据,写出该温度下(NH
4)
2SO
4 分解的化学方程式(NH
4)
2SO
4 $\frac{\underline{\;260°C\;}}{\;}$NH
4HSO
4+NH
3↑.
(2)滴定前,下列关于碱式滴定管的操作的正确顺序是dbaec(填字母编号).
a.盛装0.2000mol/LNaOH溶液 b.用0.2000mol/LNaOH溶液润洗
c.读数、记录 d.查漏、清洗 e.排尽滴定管尖嘴的气泡并调整液面
(3)加热后继续通入N
2的目的是使分解产生的气体全部逸出被充分吸收.
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂.通入N
2排尽空气后,与400℃加热装置A至(NH
4)
2SO
4完全分解无残留物,停止加热,冷却,停止通入N
2.观察到装置A、D之间的导气管内有少量白色固体.经检验,该白色固体和装置D内溶液中有SO
32-,无SO
42-.进一步研究发现,气体产物中无氮氧化物.
(4)由题述信息判断400℃时(NH
4)
2SO
4加热分解的产物中一定没有氧气的理由是装置D内溶液中有SO
32-,无SO
42-.
(5)400℃时(NH
4)
2SO
4完全分解后无固体残留,且氧化产物和还原产物各只有一种,则氧化产物是N
2,还原产物是SO
2.
(6)用下列装置测定一种分解产物的量.
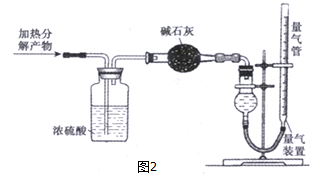
量气装置中收集到的气体是N
2,收集完气体并恢复至室温,读数前应进行的操作是将量气管两边的液面调平.




 $\stackrel{自动失水}{→}$
$\stackrel{自动失水}{→}$ +H2O
+H2O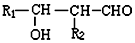
 ;G:(CH2OH)3CCHO.
;G:(CH2OH)3CCHO. .
. .
. (写一种).
(写一种).





