
科目: 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:选择题
在某恒温恒容密闭容器中,发生反应:A(g)+B(g) 2C(g) △H=-QkJ/mol,保持其它条件不变,只改变起始加入量,测得相关数据如表所示:
2C(g) △H=-QkJ/mol,保持其它条件不变,只改变起始加入量,测得相关数据如表所示:

下列说法中错误的是()
A. α1+α2=1;Φ2=Φ1 B.Φ3=2Φ1 ;Q3=2Q1
C.Φ3=Φ1=Φ2;Q3=2Q1 D. α1=α3;Q1+Q2=Q
查看答案和解析>>
科目: 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:选择题
两份体积相同,浓度未知的Na2CO3和HCl溶液,将它们互相滴加,产生的气体在相同的温度和压强下的体积比为1:2,则Na2CO3和HCl溶液的浓度之比为
A. 3:2 B. 2:5 C. 3:4 D. 4:3
查看答案和解析>>
科目: 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:填空题
X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲由X、Z、Q三种元素组成,常温下0.1mol/L甲溶液的pH=13。工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成。请回答下列问题:
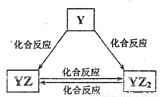
(1)Q的离子结构示意图为____________。
(2)Y元素的单质能发生如图所示的转化,请写出图中反应YZ2→YZ的化学方程式:___________(注明反应条件)。在甲溶液中通入足量YZ2气体,所得溶液呈碱性,写出该溶液中的阴离子浓度由大到小的顺序:______________。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
① 常温下,将W的单质和甲溶液混合,发生反应的离子方程式为____________;
② Q、W金属性的强弱为Q>W,下列表述中正确的且能证明这一事实的是__________(填序号)
a. Q单质的熔点比W单质的低
b. W单质的硬度比Q大
c. Q单质能将W从它的盐溶液中置换出来
d. Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
查看答案和解析>>
科目: 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:实验题
某化学兴趣小组的同学们对SO2与漂粉精、过氧化钠的反应进行实验探究:
【实验I】SO2与漂粉精反应。
操作 | 现象 |
取4g 漂粉精固体,加入100mL 水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
| 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的反应中氧化剂与还原剂的物质的量之比为__________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是____________。
(3)兴趣小组将A中产生的白雾引出导入硝酸酸化的AgN03溶液中,有沉淀产生,据此判断白雾成分为HCl小液滴,该结论合理吗?____________请说明理由____________________。
(4)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。该反应的离子方程式为______________。
(5)①将A瓶中混合物过滤、洗涤,得到沉淀X,X的成分是____________(填化学式);
② 用离子方程式解释现象3中黄绿色褪去的原因____________________。
【实验II】SO2与过氧化钠反应。将一定量(过量)SO2充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好。在室温下按图示装置进行实验,请填写空白。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | (1)_______ | (2)反应的化学方程式:_________________ |
将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | (3)________ | (4)不用解释 |
查看答案和解析>>
科目: 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:实验题
KMnO4和MnO2都是重要化学物质,在实验室可以做氧化剂和催化剂,某学习小组对两种物质的制备和性质探究如下:
I.MnO2的制备:
该学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其工艺流程如下:
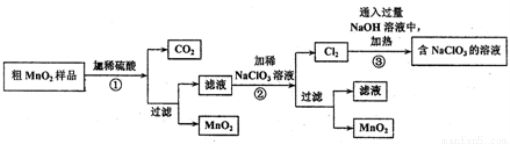
请回答下列问题:
(1)第①步操作中,生成CO2的化学方程式为____________。
(2)第②步操作中,NaClO3氧化MnSO4的离子方程式为_____________。
(3)第③步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_________(填序号)。
a. NaCl b. NaClO c. NaClO4 d. NaOH
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤。洗涤沉淀所用的玻璃仪器有:_____________,判断是否洗涤干净可选用的试剂是____________(填化学式)。
(5)NaClO3和MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等量的氯气消耗NaClO3与MnO2的物质的量之比为__________。
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程的阳极反应式为___________。
II.KMnO4的制备和性质:
(7)实验室由二氧化锰制备高锰酸钾可分二步进行:
第一步:MnO2与KOH共熔并通入氧气:2MnO2+4KOH+O2=2K2MnO4+2H2O
第二步:通入CO2,可使K2MnO4发生歧化反应生成KMnO4和MnO2。
第二步完成反应时,转化为KMnO4的K2MnO4占其全部的百分率约为_______(精确到0.1%)
(8)该小组同学为了探究KMnO4溶液和Na2C2O4溶液的反应过程,将酸性KMnO4溶液逐滴滴入一定体积的Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:

请将MnO4-氧化C2O42- 的离子方程式补充完整:
______MnO4-+C2O42-+_______=______Mn2++_____CO2↑+_______
请分析KMnO4溶液褪色时间变化的可能原因_____________________。
查看答案和解析>>
科目: 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:填空题
目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ/mol
2NH3(g) △H=-93.0kJ/mol
(1)己知一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=+1530.0kJ/mol。
4NH3(g)+3O2(g) △H=+1530.0kJ/mol。
则表示氢气燃烧热的热化学方程式为____________________。
(2)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。
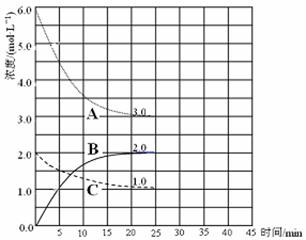
① 表示N2浓度变化的曲线是 (填序号)。
② 前25min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25min时,采取下列措施,能使N2的转化率提高的是_________(填序号)。
a.通入1molN2 b. 通入1molH2 c. 通入1molHe气
d. 通入1molNH3 e. 通入1molHCl f. 通入1molN2和3molH2
(3)在恒温恒压装置中进行工业合成氨反应,下列说法错误的是_________(填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(4)电厂烟气脱氮:主反应为:①4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0
5N2(g)+6H2O(g) △H<0
副反应为:②2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0
5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如右图所示。

请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是__________,导致这种规律的原因是___________。
查看答案和解析>>
科目: 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
建设“碧水蓝天”的生态城市,下列措施中不合理的是( )
A.加高烟囱,减少烟尘对周围环境的影响
B.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
C.积极推广太阳能、风能等新能源的使用,减少化石燃料的 使用
使用
D.加强城市生活污水脱氮除磷处理,遏制水体富营养化
查看答案和解析>>
科目: 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列有关物质的性质与用途具有对应关系的是( )
A.SO2具有还原性,可用于漂白纸浆
B.MgO熔点高,可用作耐高温材料
C. KAl(SO4)2·12H2O易溶于水,可用作净水剂
D.NH4Cl受热易分解,可用作氮肥
查看答案和解析>>
科目: 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质 | 实际应用 | |
A. | 三价铁比二价铜氧化性强 | FeCl3腐蚀Cu |
B. | 次氯酸盐具有氧化性 | 次氯酸钙可做漂白剂 |
C. | 稀硝酸可与银反应 | 稀硝酸可除去试管内壁 |
D. | HF能与Si反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
查看答案和解析>>
科目: 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
化学在工农业生产和日常生活中都有着重要的应用。下列说法错误的是( )
A.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体
B.锅炉水垢中含有 的CaSO4,可先用Na2CO3溶液处理,后用酸除去
的CaSO4,可先用Na2CO3溶液处理,后用酸除去
C.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
D.防止酸雨发生的重要措施之一是使用清洁能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com