
科目: 来源: 题型:选择题

| A. | 左室中NaOH的浓度不变 | |
| B. | 工作时,OH-向左迁移 | |
| C. | 右室电极反应为C2H5OH+5OH--4e-=CH3COO-+4H2O | |
| D. | 右室生成CH3COONa1.5mol,理论上左室生成氢气67.2L |
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:选择题
 在15mL0.10mol•L-1NaOH 溶液中逐滴加入 0.20mol•L-1 的氢氰酸(HCN,一元弱酸)溶液,溶液的pH和加入的氢氰酸溶液的体积关系曲线如图所示,有关粒子浓度大小关系正确的是( )
在15mL0.10mol•L-1NaOH 溶液中逐滴加入 0.20mol•L-1 的氢氰酸(HCN,一元弱酸)溶液,溶液的pH和加入的氢氰酸溶液的体积关系曲线如图所示,有关粒子浓度大小关系正确的是( )| A. | 在 A、B 间任意一点:c(Na+)>c(CN-)>c(OH-)>c(H+) | |
| B. | 在 B 点:c(Na+)═c(CN-)>c( OH-)=c(H+),且 a=7.5 | |
| C. | 在 C 点:c(CN-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 在 D 点:c(HCN)+c(CN-)>2c(Na+) |
查看答案和解析>>
科目: 来源: 题型:解答题
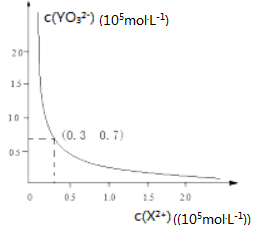
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
 常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )
常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )| A. | HR为强电解质 | |
| B. | 图中四点,水的电离程度:c>b>d>a | |
| C. | 若常温时,0.1mol/LHR溶液的电离度为1%,则常温时R+的水解常数约为10-9 | |
| D. | b点溶液中存在c(Na+)=c(R+)+c(HR) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 27 mg | B. | 54 mg | C. | 108 mg | D. | 216 mg |
查看答案和解析>>
科目: 来源: 题型:解答题
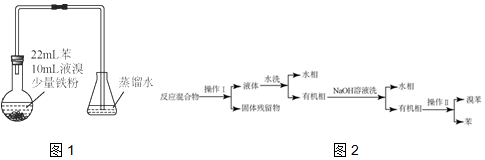
 .
.| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | |||
| 2 | 锥形瓶中液体含大量 | ||
| 3 | 锥形瓶中液体含大量 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com