
科目: 来源: 题型:实验题
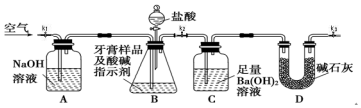
| 实验步骤 | 预期现象与结论 |
| 取适量牙膏样品于试管中,加入足量的NaOH溶液,过滤,向滤液中滴加盐酸. | 滤液中先出现白色沉淀,随后沉淀溶解,说明该牙膏摩擦剂中含氢氧化铝. |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| B. | 鸡蛋清溶液中滴加醋酸铅溶液会发生盐析 | |
| C. | 使用无铅汽油的汽车尾气不会污染空气 | |
| D. | 水体中植物营养物质过多积累会引起水体富营养化 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 化学式 | 沉淀开始时的pH | 沉淀完全时的pH | 有关性质 |
| Co(OH)2 | 7.2 | 9.4 | Co+2HCl═CoCl2+H2↑ Co2++2NH3•H2O═Co(OH)2↓+2NH4+ Co2++2H2O?Co(OH)2+2H+ Ni+2HCl═NiCl2+H2↑ Ni2++6NH3•H2O═Ni(NH3)6]2++6H2O |
| Fe(OH)2 | 7.1 | 9.6 | |
| Fe(OH)3 | 2.3 | 3.7 | |
| Mg(OH)2 | 10.8 | 12.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
 ;所含化学键类型离子键、非极性共价键.
;所含化学键类型离子键、非极性共价键.查看答案和解析>>
科目: 来源: 题型:解答题
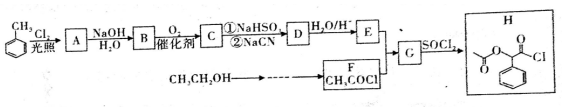

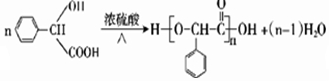 .
.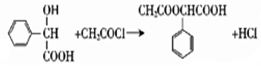 .
.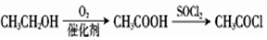 .
.查看答案和解析>>
科目: 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
| 开始沉淀时的pH | 2.7 | 6.6 | 5.2 | 4.4 |
| 沉淀完全时的pH | 3.7 | 8.9 | 8.1 | 5.7 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Q的同分异构体数目少于CxH12 | |
| B. | 用酸性高锰酸钾溶液可以区分CxHy和Q | |
| C. | 上述转化过程中依次发生了加成反应和取代反应 | |
| D. | x=5、n=10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com