
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
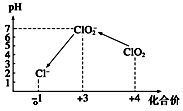 二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请用如图实验装置,选用适当的化学试剂和实验用品,设计并完成对过氧化钠这一性质的探究.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请用如图实验装置,选用适当的化学试剂和实验用品,设计并完成对过氧化钠这一性质的探究.查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:选择题
 已知常温时0.1mol/L的CH3COOH溶液pH约为2.5,将20mL 0.1mol/L CH3COOH溶液和20mL 0.1mol/L的HSCN溶液分别于等体积等浓度的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图.下列说法不正确的是( )
已知常温时0.1mol/L的CH3COOH溶液pH约为2.5,将20mL 0.1mol/L CH3COOH溶液和20mL 0.1mol/L的HSCN溶液分别于等体积等浓度的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图.下列说法不正确的是( )| A. | 常温时CH3COOH的电离平衡常数约为10-4 | |
| B. | 结合质子的能力:SCN->CH3COO->HCO3- | |
| C. | 反应结束后溶液中c(CH3COO-)<c(SCN-) | |
| D. | 等体积等pH的CH3COOH和HSCN分别与20mL 0.1mol/L的NaHCO3溶液反应,开始时两者产生CO2的速率相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
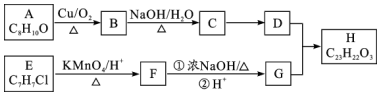
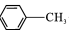 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$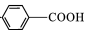
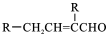
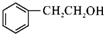 ,C→D的反应类型为加成反应;B中含氧官能团名称为醛基,F中不含氧的官能团的名称为氯原子; H的结构简式为
,C→D的反应类型为加成反应;B中含氧官能团名称为醛基,F中不含氧的官能团的名称为氯原子; H的结构简式为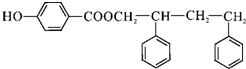 ;
;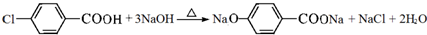 ;
;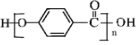 ;
;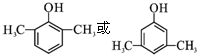 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com