
科目: 来源: 题型:实验题
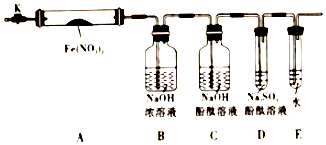 固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题
 ,所含化学键类型为共价键.
,所含化学键类型为共价键.查看答案和解析>>
科目: 来源: 题型:推断题
 ;Y是火箭发动机的燃料,已知3.2g Y与足量A2C2反应生成两种气态产物,其中一种产物是空气的主要成分,同时放出Q kJ的热量,写出其热化学反应方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-10QkJ/mol.
;Y是火箭发动机的燃料,已知3.2g Y与足量A2C2反应生成两种气态产物,其中一种产物是空气的主要成分,同时放出Q kJ的热量,写出其热化学反应方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-10QkJ/mol.查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:实验题
 已知X、Y、Z、M、G是五种短周期主族元素,且原子序数依次增大,X原子核内只有1个质子;Y的原子最外层电子数是其电子层数的2倍,Y与G同主族;Z的一种单质能吸附对人体有害的紫外线;M是地壳中含量最高的金属元素.
已知X、Y、Z、M、G是五种短周期主族元素,且原子序数依次增大,X原子核内只有1个质子;Y的原子最外层电子数是其电子层数的2倍,Y与G同主族;Z的一种单质能吸附对人体有害的紫外线;M是地壳中含量最高的金属元素.查看答案和解析>>
科目: 来源: 题型:解答题
 氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题:
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 | 原子结构或元素性质 |
| X | 单质在常温下为黄绿色气体,水溶液具有漂白性 |
| Y | 短周期主族元素中原子半径最大 |
| Z | 常见的金属,既能与强酸反应又能与强碱反应 |
| M | 最高正价与最低负价代数和为4 |
| N | N是一种生命元素,人体缺少该元素会发生贫血,使人脸色萎黄 有三种氧化物,其中一种氧化物具有磁性 |
 ;
;查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com