
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=-3 540 kJ•mol-1 | |
| B. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=-3 540 kJ•mol-1 | |
| C. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=+3 540 kJ•mol-1 | |
| D. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=+3 540 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
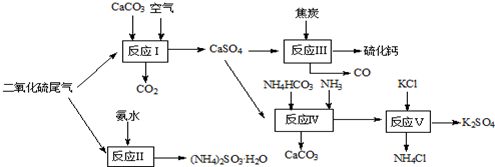
查看答案和解析>>
科目: 来源: 题型:推断题
 ,乙物质中含有的化学键是离子键、共价键;
,乙物质中含有的化学键是离子键、共价键; ,
,查看答案和解析>>
科目: 来源: 题型:解答题
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
 ,G与F分别形成的简单离子半径大小关系为N3->Na+.
,G与F分别形成的简单离子半径大小关系为N3->Na+. 、
、 .
. ;
; ,该化合物与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑..
,该化合物与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑..查看答案和解析>>
科目: 来源: 题型:解答题
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A 原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的 原子序数为29.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A 原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的 原子序数为29.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com