
科目: 来源: 题型:解答题
 .写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑.
.写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
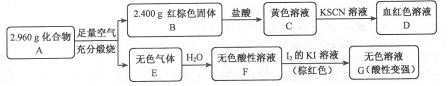
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
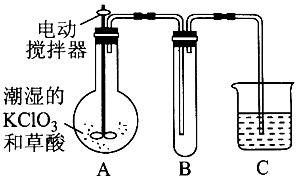
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目: 来源: 题型:解答题
 将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:查看答案和解析>>
科目: 来源: 题型:实验题
 纳米级Fe粉是新型材料,具有超强磁性、高效催化性.某化学小组探究用氢气和碳酸亚铁制取纳米级铁粉.其实验设计如图(加热、支持装置省略)
纳米级Fe粉是新型材料,具有超强磁性、高效催化性.某化学小组探究用氢气和碳酸亚铁制取纳米级铁粉.其实验设计如图(加热、支持装置省略)查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com