
科目: 来源: 题型:解答题

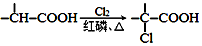

 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaCl.
+NaCl. .
. 为原料制取
为原料制取  的合成路线图.合成路线图示例如下:
的合成路线图.合成路线图示例如下:查看答案和解析>>
科目: 来源: 题型:填空题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
 .
.
查看答案和解析>>
科目: 来源: 题型:解答题


 .
. .
. .
. .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题

 +2nH2O⑩
+2nH2O⑩
查看答案和解析>>
科目: 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mg2+ | 8.1 | 9.4 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 在容积为 1.0L 的密闭容器中进行反应:A(g)=B(g)+C(g),A 的初始浓度为 0.5mol?L-1.在温度T1、T2 下,A 的浓度与时间关系如图所示,回答下列问题:
在容积为 1.0L 的密闭容器中进行反应:A(g)=B(g)+C(g),A 的初始浓度为 0.5mol?L-1.在温度T1、T2 下,A 的浓度与时间关系如图所示,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
| 反应 | 大气固氮 N2 (g)+O2 (g)?2NO(g) | 工业固氮 N2 (g)+3H2 (g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |

查看答案和解析>>
科目: 来源: 题型:解答题
 .
. .
. .
. 、
、 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com