
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |

查看答案和解析>>
科目: 来源: 题型:实验题
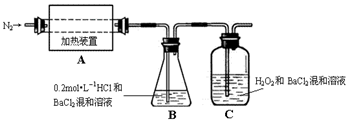
 某初级中学学生发现实验室里有一瓶标签破损的无色溶液 (如图所示),于是在老师的指导下进行如下探究.
某初级中学学生发现实验室里有一瓶标签破损的无色溶液 (如图所示),于是在老师的指导下进行如下探究.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
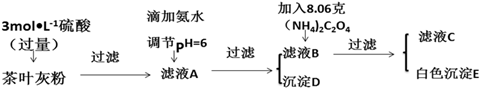
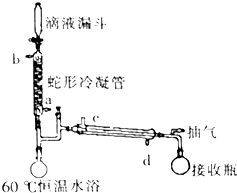 过氧乙酸是高效、速效、广谱灭菌剂.实验室合成与含量测定的相关步骤如下:
过氧乙酸是高效、速效、广谱灭菌剂.实验室合成与含量测定的相关步骤如下: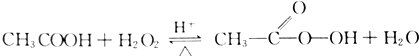 ,向装有搅拌装置及温度计的500ml三口烧瓶中先加入16.0g冰醋酸,然后在搅拌下滴加90g浓缩后的H2O2溶液,最后加入7.5ml浓硫酸,搅拌下加热5h,静置20h.
,向装有搅拌装置及温度计的500ml三口烧瓶中先加入16.0g冰醋酸,然后在搅拌下滴加90g浓缩后的H2O2溶液,最后加入7.5ml浓硫酸,搅拌下加热5h,静置20h.查看答案和解析>>
科目: 来源: 题型:实验题

| 序号 | 固体成分(填化学式) |
| 1 | |
| 2 | |
| 3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA | |
| B. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| C. | 标准状况下,22.4 L氮气与22.4 L苯所含分子数均为 NA | |
| D. | 常温常压下,32gO2、O3的混合物含有2NA个氧原子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 公益调查--柴静雾霾调查《穹顶之下》发布,其中雾霾中的PM2.5属于胶体 | |
| B. | 油脂是人类维持生命活动所需能量的主要来源 | |
| C. | 核磁共振氢谱不能区分CH3CH2OH和CH3OCH3 | |
| D. | 登高山时防晒是为防止强紫外线引起皮肤蛋白质被灼伤变性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com