
科目: 来源: 题型:实验题
| 滴定次数 | 样品的质量/g | 稀盐酸的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 21.03 |
| 2 | 0.3000 | 2.00 | 21.99 |
| 3 | 0.3000 | 0.20 | 20.20 |

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
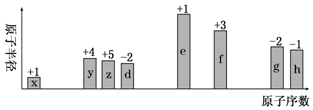
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 23 g钠的原子最外层电子数为2NA | |
| B. | 1 L 0.1 mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 标准状况下,22.4 L乙烷的分子数为NA | |
| D. | 1 mol甲基所含质子数为10NA |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
| ② | 滴加淀粉KI溶液,振荡 | 溶液无变化 |
| ③ | 然后再滴加稀H2SO4溶液,振荡 | 溶液变蓝色 |
| 实验操作 | 实验现象及结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com