
科目: 来源: 题型:选择题
| A. | WX2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2是酸性氧化物 | |
| C. | X与Z的氢化物中沸点较高的是Z | |
| D. | WX2中只含有极性键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室制备乙炔时,为减慢反应速率,可用饱和食盐水代替水 | |
| B. | 可以用NaOH溶液除去苯中的溴杂质 | |
| C. | 用KMnO4酸性溶液可以除去乙烯中混有的乙炔 | |
| D. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷、甲苯、乙醇、乙酸都可以发生取代反应 | |
| B. | 可用浓溴水来区分乙醇和苯酚 | |
| C. | 乙酸乙酯在无机酸或碱存在时都能发生水解反应 | |
| D. | 能发生水解反应的有机物只有卤代烃和酯类 |
查看答案和解析>>
科目: 来源: 题型:解答题
 石墨晶体由层状石墨“分子”按 ABAB方式堆积而成,如右图(a)所示,并给出了一个石墨的六方晶胞如图(b)所示.
石墨晶体由层状石墨“分子”按 ABAB方式堆积而成,如右图(a)所示,并给出了一个石墨的六方晶胞如图(b)所示.查看答案和解析>>
科目: 来源: 题型:解答题
 硫化锌荧光材料的研究从1868年法国化学家Sidot发现至今已有近150年的历史.其中立方硫化锌的晶胞如右图所示.请回答下列问题:
硫化锌荧光材料的研究从1868年法国化学家Sidot发现至今已有近150年的历史.其中立方硫化锌的晶胞如右图所示.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
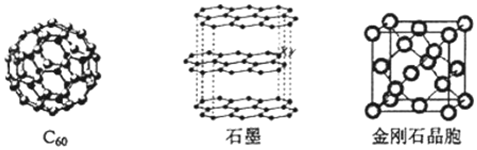
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 受热时Na2CO3较NaHCO3更不稳定,更易分解产生CO2 | |
| B. | 等质量的Na2CO3、NaHCO3与足量盐酸反应,前者产生的CO2更多 | |
| C. | 常温下相同物质的量浓度的Na2CO3、NaHCO3溶液,前者碱性更强 | |
| D. | 向Na2CO3、NaHCO3溶液中分别滴加澄清石灰水,前者产生白色沉淀,后者无沉淀 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题
 中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定.
中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com