
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
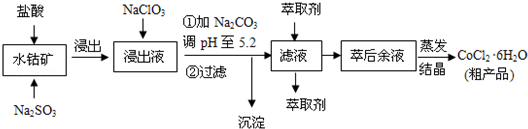
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,流程如下
,流程如下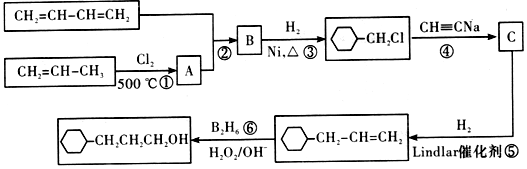
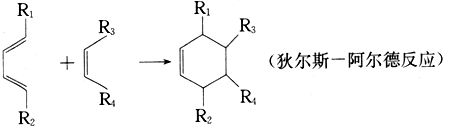
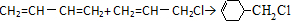
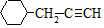
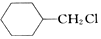 含有六元环且核磁共振氢谱有4组峰值的同分异构体的结构筒式
含有六元环且核磁共振氢谱有4组峰值的同分异构体的结构筒式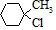
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 将SO2通入紫色石蕊溶液中 | 证明SO2具有漂白性 |
| B | 取两支试管,分别加入4mL0.01mol•L-1KMnO4溶液,然后向一支试管中加0.1mol•L-1H2C2O4溶液2mL,向另一支试管中加入0.1mol•L-1H2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大,反应速率越快 |
| C | 向10mL0.2mol•L-1NaOH溶液中滴入2滴入两滴0.1mol•L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1FeCl2溶液,又生成红褐色沉淀 | 证明在相同温度下的溶度积:Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向含酚酞的Na2SO4溶液中加入BaCl2溶液 | 证明Na2SO4溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A、D两种元素形成的化合物中只含有极性键 | |
| B. | A、C、D三种元素形成的化合物一定是共价化合物,其溶液一定呈酸性 | |
| C. | 六种元素中,最高价氧化物对应水化物酸性最强的元素是C | |
| D. | 原子半径由大到小的顺序是F>E>C>D |
查看答案和解析>>
科目: 来源: 题型:解答题
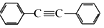 以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如图:
以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如图:
 ,B的官能团名称为羰基.
,B的官能团名称为羰基. .
. .
. 或
或 .
. 的合成路线:
的合成路线: .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将1g碳酸钠固体和1g碳酸氢钠固体分别加入两支试管,加10mL水溶解后,滴加1~2滴酚酞溶液 | 碳酸钠溶液显红色,碳酸氢钠溶液显浅红色 | 碳酸钠溶液碱性比碳酸氢钠溶液碱性强 |
| B | 除锈的铁钉在浓硝酸中浸泡后,用蒸馏水洗净,再加入CuSO4溶液中 | 无明显现象 | 铁不与CuSO4溶液反应 |
| C | 将SO2和CO2气体分别通入水中至饱和,立即用pH计测两溶液的pH | 前者的pH小于后者 | H2SO3酸性强于H2CO3 |
| D | 向2mL0.1mol/LNa2S溶液中滴入几滴0.1mol/LZnSO4溶液,再加入几滴0.1mol/LCuSO4溶液 | 开始有白色沉淀生成,后又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题

| A. | X难溶于乙醇 | |
| B. | 酒中的少量丁酸能抑制X的水解 | |
| C. | X完全燃烧后生成CO2和H2O的物质的量比为1:1 | |
| D. | 分子式为 C5H10O2且能与NaHCO3溶液反应生成气体的物质有5种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应中生成O2的质量与反应消耗H2O中氧元素的质量相等 | |
| B. | 18 g H218O和18 g H2O中含有的质子数均为10NA | |
| C. | 标准状况下,22.4 L CO2与22.4L18O2所含氧原子数均为2NA | |
| D. | 每消耗 1 mol H218O,反应中转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com