
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

 的合成路线:
的合成路线: .
.查看答案和解析>>
科目: 来源: 题型:解答题

 $\stackrel{H_{2}O}{→}$2RCOOH ②RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH
$\stackrel{H_{2}O}{→}$2RCOOH ②RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH .
. .
.
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
 常温下向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法正确的是( )
常温下向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法正确的是( )| A. | HA为一元弱酸,MOH为一元强碱 | |
| B. | K点溶液中各微粒浓度大小关系,c(M+)>c(A-)>c(MOH)>c(OH-)>c(H+) | |
| C. | N点水的电离程度小于K点水的电离程度 | |
| D. | 若K点对应溶液的pH=10,则c(MOH)+c(OH-)=0.02mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题

 ;
; ;
; .
. .
. .
. 和
和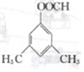 .
. . 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体
. 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体 的合成路线:
的合成路线: .
.查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
 世界上最早现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载.回答下列问題:
世界上最早现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载.回答下列问題:查看答案和解析>>
科目: 来源: 题型:解答题
 (1)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
(1)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目: 来源: 题型:选择题
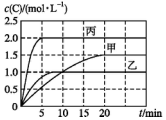 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间的变化关系分别以表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间的变化关系分别以表和图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10 min内甲容器中反应的平均速率v(A)=0.025 mol•L-1•min-1 | |
| B. | 由图可知:T1<T2,该反应为吸热反应 | |
| C. | x=1,若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T2℃时,丙容器比乙容器反应快的原因是使用了催化剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
 铝是一种重要的金属.在生产、生活中具有许多重要的用途,图是从铝土矿中制备铝的工艺流程.已知:
铝是一种重要的金属.在生产、生活中具有许多重要的用途,图是从铝土矿中制备铝的工艺流程.已知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com