
科目: 来源: 题型:选择题
 一定温度压强下,NO在某恒容密闭容器中分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示.下列说法正确的是( )
一定温度压强下,NO在某恒容密闭容器中分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示.下列说法正确的是( )| A. | 该反应是一个可逆反应 | B. | 反应后体系内压强增大 | ||
| C. | Y、Z的化学式分别是N2O、N2O3 | D. | Y、Z的化学式分别是N2O、NO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4L苯中含σ键数目为12NA | |
| B. | 常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA | |
| C. | 常温下,1.0L 0.1 mol•L-1 FeCl3溶液中,Fe3+离子数目为0.1NA | |
| D. | O3氧化NO 结合水洗可产生HNO3和O2,每生成1mol HNO3转移的电子数为6NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用催化剂的目的是提高反应物的转化率 | |
| B. | 循环使用N2、H2的目的是提高氨的产率 | |
| C. | 温度控制在500℃左右的目的是有利于化学平衡向正反应方向移动 | |
| D. | 高压下反应有利于增大反应速率,所以压强越高越好 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 提高盐酸的浓度 | B. | 搅拌反应物 | C. | 高温下酸浸 | D. | 粉碎煤矸石 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 现向10mL浓度为0.1 mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中水的电离程度始终增大 | |
| B. | 保存Fe(NO3)2溶液时,应在其中加入稀HNO3以抑制Fe2+水解 | |
| C. | 将AlCl3溶液蒸干可得到固体AlCl3 | |
| D. | 向0.1 mol•L-1氨水中加入少量水,pH减小,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 因为水分子内含有氢键,所以水的沸点比硫化氢的沸点高 | |
| B. | N3-离子与CO2分子互为等电子体 | |
| C. | CHBrCl2分子中的碳原子为手性碳原子 | |
| D. | SO2和CO2均为直线形结构 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
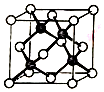 冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或圆心,实心球所示原子位于立方体内)类似.下列有关冰晶胞说法合理的是( )
冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或圆心,实心球所示原子位于立方体内)类似.下列有关冰晶胞说法合理的是( )| A. | 冰晶胞内水分子间以共价键结合 | |
| B. | 晶体冰与金刚石晶体硬度都很大 | |
| C. | 冰分子间的氢键无方向性和饱和性 | |
| D. | 氢键存在导致冰晶胞与金刚石晶胞排列方式类似 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该电池锌为负极,发生氧化反应 | |
| B. | 电池正极反应式为MnO2+e-+H2O═MnO(OH)+OH- | |
| C. | 当0.1mol Zn完全溶解时,电池外电路转移的电子个数约为1.204×1023 | |
| D. | 当该电池工作时,负极周围的pH值变大 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com