
科目: 来源: 题型:选择题
| A. | 1 mol苯分子中含有碳碳双键的数目为3 NA | |
| B. | 标准状况下,11.2 L CCl4中含有的共价键数目为2 NA | |
| C. | 1 mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3 NA | |
| D. | 常温常压下,0.5 mol 羟基含有的电子总数为5 NA |
查看答案和解析>>
科目: 来源: 题型:解答题
 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.查看答案和解析>>
科目: 来源: 题型:解答题
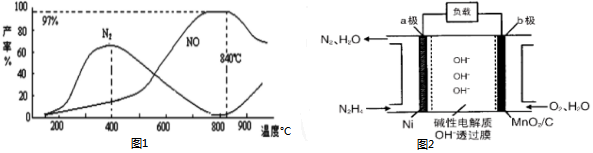
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA | |
| B. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 | |
| C. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.01NA | |
| D. | 10mL5mol/L(NH4)2SO4溶液中含有NH+4数目为0.2NA个 |
查看答案和解析>>
科目: 来源: 题型:解答题
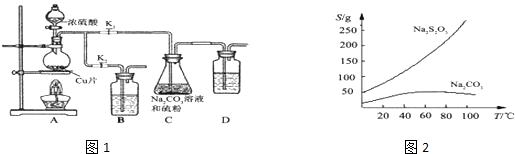
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③⑤⑥⑧⑩ | B. | ②③④⑤⑨⑩ | C. | ③⑤⑦⑩ | D. | ①③⑤⑩ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3CH2Br→CH3CH2OH→CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br→CH2=CH2 $\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br→CH2=CH2 $\stackrel{Br_{2}}{→}$CH2BrCH2Br |
查看答案和解析>>
科目: 来源: 题型:解答题

 不能最终被氧化为-COOH;
不能最终被氧化为-COOH;查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com