
科目: 来源: 题型:选择题

| A. | ZM2分子中各原子的最外层均满足8电子稳定结构 | |
| B. | 离子半径:M->Z2->Y- | |
| C. | 电负性:Y>Z>M | |
| D. | Z元素基态原子最外层电子排布图为: |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HF、HCl、HBr、HI | B. | F2、Cl2、Br2、I2 | ||
| C. | H2O、H2S、H2Se、H2Te | D. | CI4、CBr4、CCl4、CF4 |
查看答案和解析>>
科目: 来源: 题型:解答题
 科学家参考自然界中的光合作用,设计利用太阳能促进燃料的循环使用(如图),其中过程Ⅰ的主要反应如下:
科学家参考自然界中的光合作用,设计利用太阳能促进燃料的循环使用(如图),其中过程Ⅰ的主要反应如下:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
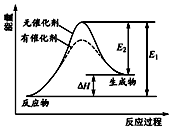 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 催化剂能降低反应的活化能 | |
| C. | 该反应的△H=E2-E1 | |
| D. | 该图可以表示燃料燃烧反应的能量变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
 如图为氢氧燃料电池装置示意图.
如图为氢氧燃料电池装置示意图.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na与H2O反应 | B. | H2在Cl2中燃烧 | ||
| C. | NaOH溶液与盐酸反应 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验编号 | C(I-)/mol•L | C(S2O82-)/mol•L | t/s |
| 1 | 0.040 | 0.040 | 88.0 |
| 2 | 0.080 | 0.040 | 44.0 |
| 3 | 0.080 | 0.080 | 22.0 |
| 4 | 0.160 | 0.020 | 44.0 |
| 5 | 0.120 | 0.040 | 29.3 |
| A. | I-的浓度越大,反应速率越快 | |
| B. | S2O82- 的浓度越大,反应速率越快 | |
| C. | 该实验的目的是研究 I- 与S2O82- 的浓度对反应速率的影响 | |
| D. | 5个实验中,编号3对应浓度的实验,反应速率最慢 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 18g H2O含有的电子数8NA | |
| B. | 常温常压下,1L0.2mol/L MgCl2溶液中含Cl-数为0.2NA | |
| C. | 常温常压下,22.4L的氧气中含氧原子数为2NA | |
| D. | 2.4g的Mg粉与足量的盐酸反应失去电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com