
科目: 来源: 题型:实验题

| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
查看答案和解析>>
科目: 来源: 题型:选择题
 煤的气化是煤高效、洁净利用的方向之一.如图为加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知该煤气中( )
煤的气化是煤高效、洁净利用的方向之一.如图为加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知该煤气中( )| A. | 只含有碳、氢两种元素 | B. | 所含的有机物是CH4、CnHm | ||
| C. | CO体积分数大于CH4体积分数 | D. | 低温有助于提高H2的含量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | V1>V2>V3 | B. | V3>V2>V1 | C. | V3>V1=V2 | D. | V1>V2=V3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 粗铜精炼时,阴极质量增加:Cu2++2e-=Cu | |
| B. | 明矾可用作净水剂:Al3++3H2O=Al(OH)3↓+3H+ | |
| C. | 向氢氧化镁浊液中滴入酚酞溶液,溶液变红:Mg(OH)2(s)?Mg2+(aq)+2OH- | |
| D. | Na2CO3溶液显碱性:CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该反应是放热反应 | B. | 升高温度平衡向逆反应方向移动 | ||
| C. | 增大压强,平衡不发生移动 | D. | 升高温度,反应的平衡常数K增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
 )有如下转化关系:
)有如下转化关系:
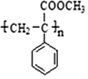 .
. .
. .
.查看答案和解析>>
科目: 来源: 题型:推断题
 有A、B、C、D、E、F六种微粒,E气体能使湿润的红色石蕊试纸变蓝色其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,E气体能使湿润的红色石蕊试纸变蓝色其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料 电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料 电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| B. | 每消耗3 mol H2O2,转移的电子为6 mol | |
| C. | b电极为正极,发生氧化反应 | |
| D. | 该电池的负极反应为:BH4-+8OH-+8e-═BO2-+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com