
科目: 来源: 题型:选择题
| A. | 离子化合物中可能含共价键,共价化合物也可能含离子键 | |
| B. | 任何分子中一定含有化学键 | |
| C. | NaCl、NaOH、Na2O2 四种物质中含有的化学键类型完全相同 | |
| D. | 共价化合物中不一定只存在极性共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ①②③⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D | |
| 装 置 | 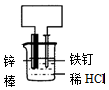 |  |  |  |
| 结论 | 能防止铁钉腐蚀 | 能证明非金属性Cl>C>Si | 能分离出Cl2与KI溶液反应生成的碘 | 可制取乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | H2、I2和HI分子中的化学键都是非极性共价键 | |
| B. | 断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ | |
| C. | 相同条件下,1 mol H2(g)和1mol I2(g)总能量小于2 mol HI (g)的总能量 | |
| D. | 向密闭容器中加入1 mol H2(g)和1 mol I2(g),充分反应后放出的热量为a kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同温度下,CuS的溶解度大于ZnS的溶解度 | |
| B. | 除去工业废水中的Cu2+,可以选用FeS做沉淀剂 | |
| C. | 因为H2SO4是强酸,所以Cu2++H2S═CuS↓+2H+不能发生 | |
| D. | 将足量CuSO4溶解在0.1 mol•L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将苯、液溴和铁粉混合产生的气体直接通入AgNO3溶液中产生淡黄色沉淀说明苯和液溴发生了取代反应 | |
| B. | 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明,说明生成的1,2-二溴乙烷无色且可溶于四氯化碳 | |
| C. | 用CH3COOH 溶液做导电性实验,灯泡很暗,能证明 CH3COOH 是弱电解质 | |
| D. | 将铝热剂溶于足量稀盐酸后再滴入几滴K3[Fe(CN)6]溶液出现蓝色沉淀,铝热剂中一定含有氧化亚铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com