
科目: 来源: 题型:选择题
| A. | 向淀粉溶液中加入稀硫酸加热后,再用NaOH中和,并做银镜反应实验--检验淀粉是否完全水解 | |
| B. | 欲除去混在苯中的少量苯酚,可以加入氢氧化钠溶液后,充分振荡,静置后分液 | |
| C. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| D. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热--检验混合物中是否含有甲醛 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:Na>Mg>Al>O>F | B. | 离子半径:O>F>Na>Mg>Al | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:RbOH<KOH<NaOH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 所有主族元素原子的最外层电子数等于元素的最高正化合价 | |
| B. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| C. | P、S、Cl的得电子能力和最高价氧化物的水化物的酸性均依次增强 | |
| D. | 多电子原子中,在离核较近的区域内运动的电子的能量较高 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 实 验 目 的 | 试剂及方法 |
| 证明NaOH溶液具有碱性 | B |
| 鉴别Na2SO4溶液和(NH4)2SO4溶液 | D |
| 检验自来水中是否含有Cl2 | C |
| 区别CH4和C2H4两种无色气体 | A |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子晶体中只存在非极性共价键 | |
| B. | 在氯化钠晶体中每个Na+(或Cl-)周围都紧邻8个Cl-(Na+) | |
| C. | 离子晶体在熔化时,离子键被破坏 | |
| D. | 熔融状态下导电的晶体一定是金属晶体 |
查看答案和解析>>
科目: 来源: 题型:多选题
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生 气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生 气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )| A. | 摩尔质量之比为 2:3 | B. | 物质的量之比为 3:2 | ||
| C. | 质量之比为 3:2 | D. | 反应速率之比为 3:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入 NH4HSO4固体,v(H2)不变 | B. | 加入少量 Na2SO4 固体,v(H2)增大 | ||
| C. | 加入 CH3COONa 固体,v(H2)减小 | D. | 滴加少量 CuSO4溶液,v(H2)减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
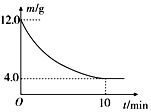 在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )
在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )| A. | 升高温度时,正反应速率增大,逆反应速率减小 | |
| B. | 随着反应的进行,混合气体的平均相对分子质量增大 | |
| C. | 增加硫酸镁的质量时,正反应速率将增大 | |
| D. | 在 0~10min内,v(CO)=0.01mol?L-1?min-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:C>D>A>B | B. | 离子半径:D>C>A>B | ||
| C. | 原子序数:B>A>D>C | D. | 氢化物稳定性:D>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com