
科目: 来源: 题型:选择题

| A. | 2Q1+Q2>4Q3 | B. | 2Q1+Q2<4Q3 | C. | Q1+Q2>4Q3 | D. | Q1+$\frac{1}{2}$Q2=2Q3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.9g | B. | 4.5g | C. | 9.0mol | D. | 13.5mol |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:选择题
| 化学键 | H-H | H-Cl | H-Br | H-I |
| 键能KJ•mol-1 | 436.0 | 431.8 | 366 | 298.7 |
| A. | 氢气 | B. | 氯化氢 | C. | 溴化氢 | D. | 碘化氢 |
查看答案和解析>>
科目: 来源: 题型:选择题
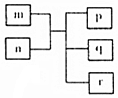 短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )| A. | 原子半径Y<Z<W | |
| B. | 简单气态氢化物的稳定性Y>Z>W | |
| C. | X与Z形成的化合物的水溶液一定为酸性溶液 | |
| D. | X、Z、W三种元素可以形成离子化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Z>X>W>Y | B. | Z>W>Y>X | C. | X>Y>Z>W>Z | D. | X>Y>Z>W |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的PH减小 | |
| C. | 中和滴定时,滴定管用所盛装的反应液润洗2〜3次 | |
| D. | 室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com