
科目: 来源: 题型:选择题

| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②用于吸收氨气,能够防止倒吸 | |
| C. | 以NH4Cl和熟石灰为原料,装置③可制备少量NH3 | |
| D. | 装置④a口进气可收集Cl2、NO等气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
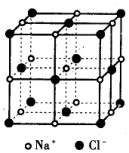 已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )| A. | 117α3ρ | B. | $\frac{M}{N{α}^{3}}$ | C. | $\frac{234}{{α}^{3}ρ}$ | D. | $\frac{58.5}{2{α}^{3}ρ}$ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,c(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,c(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 0.10 | 0.05 | 0.04 | 0.03 | 0.03 | 0.03 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 达到反应限度时SO2的消耗速率必定等于O2的生成速率 | |
| B. | 达到反应限度时,反应放出197kJ 的热量 | |
| C. | 达到反应限度时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| D. | SO2和SO3物质的量之和一定为2mol |
查看答案和解析>>
科目: 来源: 题型:选择题
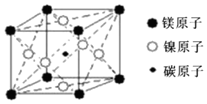
| A. | MgCNi3 | B. | MgC2Ni | C. | MgCNi2 | D. | Mg2CNi3 |
查看答案和解析>>
科目: 来源: 题型:实验题
 甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.
甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余,得100mL的溶液 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com