
科目: 来源: 题型:选择题
| A. | 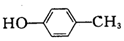 对甲苯酚 属于芳香化合物 对甲苯酚 属于芳香化合物 | B. | 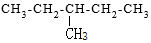 3-甲基戊烷 属于烷烃 3-甲基戊烷 属于烷烃 | ||
| C. | 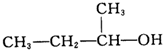 2-甲基-1-丙醇-元醇 2-甲基-1-丙醇-元醇 | D. | 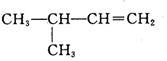 3-甲基-1-丁烯 属于脂肪烃 3-甲基-1-丁烯 属于脂肪烃 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 非金属性强弱:I>Br>Cl | B. | 原子半径大小:Na>P>S | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、NO3-、CO32-、Na+ | B. | NO3-、Ba2+、K+、Cl- | ||
| C. | Al3+、Ba2+、Mg2+、HCO3- | D. | NO3-、K+、SO32-、H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | M3O4、MO 1:1 | B. | MO2、MO 3:1 | C. | M3O4、MO2 2:1 | D. | MO2、MO 1:4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 将一小块钠分别投入盛有水和乙醇的小烧杯中,钠与乙醇反应要平缓得多 | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 |
| B | 在催化剂存在的条件下,石蜡油加强热生成的气体通入溴的四氯化碳溶液中,溶液褪色 | 石蜡油的分解产物中含有烯烃 |
| C | 向盛有Na2CO3固体的锥形瓶中滴加稀盐酸,产生无色气体 | 不能证明氯元素的非金属性强于碳元素 |
| D | 向蔗糖溶液中加入稀硫酸,水浴加热一段时间后,再加入新制Cu(OH)2悬浊液,用酒精灯加热,未见砖红色沉淀 | 蔗糖未水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 非金属元素之间只能形成共价化合物 | |
| B. | 第IA族元素的金属性一定比IIA族元素的金属性强 | |
| C. | 短周期中,同周期元素的离子半径从左到右逐渐减小 | |
| D. | 非金属元素的气态氢化物还原性越强,对应元素的最高价含氧酸酸性越弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10 g D216O中所含中子数为5NA | |
| B. | 标准状况下,22.4 L乙烷中所含共价键数目为7NA | |
| C. | 7.8g Na2O2中所含阴、阳离子总数目为0.4NA | |
| D. | 密闭容器中,1 mol N2和3 mol H2充分反应后,容器中的分子数一定大于2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=0的溶液中:NO3-、SO42-、Na+、I-能大量共存 | |
| B. | 0.1mol•L-1Na2S溶液中:c(Na+)=2c(S2-) | |
| C. | NaHSO3溶液中:c(HSO3-)+c(OH-)+c(SO32-)=c(H+)+c(Na+) | |
| D. | 等体积的硝酸和氨水混合可能存在:c(NO3-)=c(NH4+) |
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com