
科目: 来源: 题型:解答题
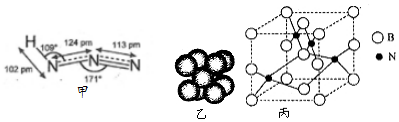
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 在pH=10.3时,溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-) | |
| B. | 在pH=8.3时,溶液中:0.1000>c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 在pH=6.3时,溶液中:c(Na+)>c(Cl-)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | V1:V2=1:2时,c(OH-)>c(HCO3-)>c(CO32-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
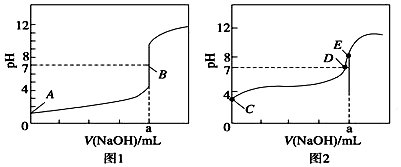
| A. | 根据图1和图2判断,滴定HBr溶液的曲线是图1 | |
| B. | a=20.00 mL | |
| C. | c(Na+)=c(CH3COO-)的点是B点 | |
| D. | E点对应溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验②证明了①的滤液中含有Ag+,由此推断①的滤液中也含有Cl- | |
| B. | 实验②证明了Kap(AgCl)<Kap(Ag2SO4) | |
| C. | 实验③的溶液中含有+微粒 | |
| D. | 由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 |
查看答案和解析>>
科目: 来源: 题型:实验题
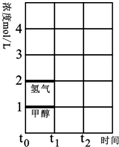 工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.如表所列数据是该反应在不同温度下的化学平衡常数(K).
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.如表所列数据是该反应在不同温度下的化学平衡常数(K).| 温度 | 250℃ | 300℃ | 350℃ |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确的是( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确的是( )| A. | V(NaOH)=0 mL时,两份溶液中,c(X-)>c(Y-) | |
| B. | V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) | |
| C. | V(NaOH)=20.00 mL时,c(OH-)>c(H+)>c(Na+)>c(X-) | |
| D. | pH=7时,两份溶液中,c(X-)=c(Na+)=c(Y-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ②③ | ||
| C. | ①② | D. | ③④ | ||
| E. | 故①②可能,答案选C. |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:多选题
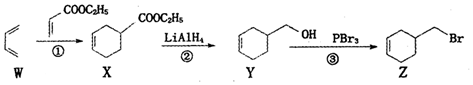
| A. | 烯烃W名称为1,3-丁二烯,所有原子一定在同一平面上 | |
| B. | ①、②、③的反应类型依次为加成反应、还原反应和取代反应 | |
| C. | 由化合物Z-步制备化合物Y的转化条件是:NaOH醇溶液,加热 | |
| D. | 化合物Y先经酸性髙锰酸鉀溶液氧化,再与乙醇在浓硫酸催化下酯化可得化合物X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com