
科目: 来源: 题型:实验题
| 操作步骤 | 预期现象 |
| ①取少量样品于试管中,加入足量的3mol/LH2SO4,充分振荡,将所得澄清的溶液分装在两支试管中. | |
| ②向一支试管中加入足量铁粉,充分振荡;再加入足量3mol/LH2SO4,充分振荡. | 若出现红色固体,则含有CuO. |
| ③向另一支试管中加入0.01mol/L酸性KMnO4溶液. | 若溶液紫红色褪去则含有FeO. |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 室温时,1.0L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| B. | 标准状况下,11.2L CH2Cl2中含有的原子数为2.5NA | |
| C. | 1.68g Fe 与足量高温水蒸气反应,转移电子数为0.09NA | |
| D. | 17g H2O2所含非极性键数目为0.5NA |
查看答案和解析>>
科目: 来源: 题型:解答题
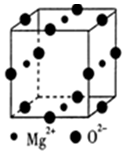 碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.
碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.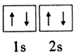 ;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).
;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).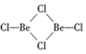 )的形式存在,在1000℃,氯化铍则以BeCl2形式存在.
)的形式存在,在1000℃,氯化铍则以BeCl2形式存在.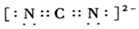 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 碳、镁、镍在工业生产和科研领域有广泛用途.请回答下列问题:
碳、镁、镍在工业生产和科研领域有广泛用途.请回答下列问题: )等.
)等. 是常用的分析试剂.其中位于同周期的三种基态原子第一电离能由小到大的顺序为C<O<N(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为OCN-.
是常用的分析试剂.其中位于同周期的三种基态原子第一电离能由小到大的顺序为C<O<N(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为OCN-.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$ NA | |
| B. | 1 mol碳正离子CH5+所含的电子数为10NA | |
| C. | 标准状态下,16 g甲烷完全燃烧所消耗氧气的分子数为NA | |
| D. | 0.5 mol C3H8分子中含C-H共价键2NA |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 短周期元素X、Y的价电子数相同,且原子序数比等于$\frac{1}{2}$;元素Z位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
短周期元素X、Y的价电子数相同,且原子序数比等于$\frac{1}{2}$;元素Z位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 物质 | 使用的试剂 | 主要操作 |
| A | 乙醇(水) | 氧化钙 | 蒸馏 |
| B | 乙酸乙酯(乙酸) | 饱和氢氧化钠溶液 | 分液 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com