
科目: 来源: 题型:选择题

| A. | 和金属钠反应时键④断裂 | |
| B. | 和氢溴酸反应时键②断裂 | |
| C. | 和浓硫酸共热140℃时键③或键④断裂;170℃时键①③断裂 | |
| D. | 在Ag催化下和O2反应键②④断裂 |
查看答案和解析>>
科目: 来源: 题型:选择题
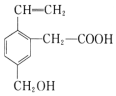
| A. | 有机物的分子式为C11H14O3 | |
| B. | 有机物中含有4种不同的官能团 | |
| C. | 0.5 mol 该有机物与足量NaOH溶液反应,消耗NaOH 1mol | |
| D. | 0.5 mol 该有机物与足量金属钠反应,能生成标准状况下的氢气11.2L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 从反应开始到平衡时,用H2表示的平均反应速率为0.15 mol•L-1•min-1 | |
| B. | 反应达到平衡时,NH3的物质的量浓度是0.5 mol•L-1 | |
| C. | 反应达到平衡时,N2和H2的物质的量之比一定为1:3 | |
| D. | 反应达到平衡时,反应物和生成物的总的物质的量之比为3:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 沸点:戊烷>2-甲基丁烷>乙二醇 | |
| B. | 密度:硝基苯>H2O>汽油 | |
| C. | 等质量的物质燃烧耗O2量:乙烯>乙炔>甲烷 | |
| D. | 等物质的量物质燃烧耗O2量:丙烷>环丙烷>2-丙醇 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分液、萃取、蒸馏、渗析 | B. | 分液、蒸馏、渗析、萃取 | ||
| C. | 萃取、蒸馏、分液、萃取 | D. | 蒸馏、萃取、渗析、萃取 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向苯酚钠溶液中通入CO2可制得苯酚,并得到碳酸钠 | |
| B. | 将铁屑、溴水、苯混合可制得溴苯 | |
| C. | 实验时不小心沾到手上的苯酚可用氢氧化钠溶液洗掉 | |
| D. | 用醋酸溶液洗涤沾附在暖水瓶内壁上水垢的过程中发生了复分解反应 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
 如图是Ca(OH)2在温度分别为T1、T2时的沉淀溶解平衡曲线[图中浓度单位为mol•L-1,温度为T1时Ca(OH)2的Ksp=4×10-6,$\root{3}{4}$≈1.6].下列说法正确的是( )
如图是Ca(OH)2在温度分别为T1、T2时的沉淀溶解平衡曲线[图中浓度单位为mol•L-1,温度为T1时Ca(OH)2的Ksp=4×10-6,$\root{3}{4}$≈1.6].下列说法正确的是( )| A. | 温度:T1<T2 | |
| B. | 温度为T1时,P点分散系中分散质粒子直径均小于1nm | |
| C. | Q点的溶液中c(OH-)约为0.0125mol•L-1 | |
| D. | 加水稀释时溶液碱性减弱,Z点溶液可转化为Q点溶液 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| 待测溶液体积/mL | 25.00 | 25.00 | 25.00 | 25.00 |
| 滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
| 滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com