
科目: 来源: 题型:选择题
| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I原子核内中子数多于质子数 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm是同一种核素 | |
| B. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的质量数相同 | |
| C. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm互为同位素 | |
| D. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的核外电子数和中子数均为62 |
查看答案和解析>>
科目: 来源: 题型:解答题


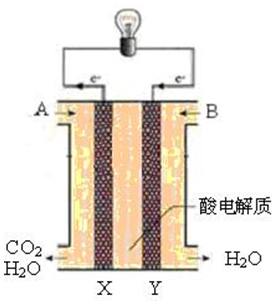
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
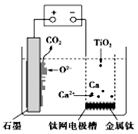 研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金金属钛.下列说法中错误的是
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金金属钛.下列说法中错误的是| A. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| B. | 在制备金属钛前后,整套装置中CaO的总量保持不变 | |
| C. | 若用铅蓄电池作供电电源,“一”接线柱应连接Pb电极 | |
| D. | 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol电子 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 其中的离子交换膜需选用阴离子交换膜 | |
| B. | 阴极的电极反应式为:2HSO3-+2e-=S2O42-+2OH- | |
| C. | 阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 反应一段时间后将惰性电极换成铁电极,对电极产物不产生影响 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 用甘氨酸( 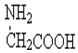 )和丙氨酸( )和丙氨酸( 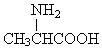 )缩合最多可形成4种二肽(不考虑形成环状) )缩合最多可形成4种二肽(不考虑形成环状) |
查看答案和解析>>
科目: 来源: 题型:解答题
 硫单质及其化合物在工农业生产中有着重要的应用.
硫单质及其化合物在工农业生产中有着重要的应用.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ①⑤ | C. | ③⑧ | D. | ③⑥⑧ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④⑤ | B. | ③⑤⑥ | C. | ②④⑥ | D. | ①②④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com