
科目: 来源: 题型:选择题
| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3-═H2O+CO2↑ | |
| B. | 铝粉与烧碱溶液反应:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| C. | 氢氧化铝与氢溴酸 Al(OH)3+3HBr═Al3++3H2O | |
| D. | 过量CO2通入漂白粉溶液中 CO2+H2O+ClO-═HCO3-+HClO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电时,正极反应为式:O2+4e-+4H+═2H2O | |
| B. | 放电时,负极反应为式:CH3OH-6e-+8OH-═CO32-+6H2O | |
| C. | 充电时,原电池的负极与电源的正极相连接 | |
| D. | 充电时,阴极反应式为:4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将SO2通入溴水中证明SO2具有漂白性 | |
| B. | 用向上排空气法收集铜粉与稀硝酸反应产生的NO | |
| C. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| D. | 将乙烯通入KMnO4酸性溶液证明乙烯具有还原性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H、D、T互为同素异形体 | B. | 质量数为31的磷原子:${\;}_{15}^{31}$P | ||
| C. | 次氯酸的电子式: | D. | 乙烯的结构简式是:CH2CH2 |
查看答案和解析>>
科目: 来源: 题型:解答题
 近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样.现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g)?CH3OH(g)△H<0,体系中n(CO)随时间的变化如表:
近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样.现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g)?CH3OH(g)△H<0,体系中n(CO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
查看答案和解析>>
科目: 来源: 题型:选择题
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A. | 苛性钾溶液中KOH的质量是16.8 | |
| B. | 反应中转移电子0.21mol | |
| C. | 氯气被还原成0.06molClO-和0.03molClO3- | |
| D. | ClO3-的生成是由于温度升高引起的 |
查看答案和解析>>
科目: 来源: 题型:多选题
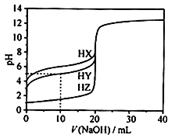 25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )
25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )| A. | HZ是强酸,HX、HY是弱酸 | |
| B. | 根据滴定曲线,可得Ka(HY)≈10-5 | |
| C. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | 将上述HY与HZ溶液等体积混合达到平衡时:C(H+)=c(OH-)=c(Z-)+c(Y-) |
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,用0.05mol/LNaOH溶液分别滴定10.00mL浓度均为0.10mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲线如图.下列说法正确的是( )
常温下,用0.05mol/LNaOH溶液分别滴定10.00mL浓度均为0.10mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲线如图.下列说法正确的是( )| A. | 对两种弱酸滴定均可选用甲基橙作指示剂 | |
| B. | ③处溶液有:c(Na+)=c(CH3COO-)<c(CH3COOH) | |
| C. | 溶液中水的电离程度:②>③>④ | |
| D. | 点①和点②溶液混合后:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) |
查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 当溶液pH=7时:c(NH4+)>c(H2CO3)+2c(CO32-) | |
| B. | 当溶液pH=9.5时:c(OH-)-c(H+)>c(NH4+)-3c(CO32-) | |
| C. | 若刚好是(NH4)2CO3溶液:c(OH-)+C(NH3•H2O)>c(H+)+c(H2CO3)+c(HCO3-) | |
| D. | 若刚好是NH4HCO3溶液,向其中加入等体积、等物质的量浓度的NaCl溶液,析出部分晶体,过滤所得的滤液中:c(Na+)=c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-) |
查看答案和解析>>
科目: 来源: 题型:解答题
 NO、NO2 和CO均为大气污染物,对其治理备受关注.请回答下列问题:
NO、NO2 和CO均为大气污染物,对其治理备受关注.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com