
科目: 来源: 题型:选择题
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的 pH 一定等于 7 | |
| B. | 0.1 mol•L-1 NH4Cl 溶液与 0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 向 0.10 mol•L-1Na2SO3溶液中通 SO2 气体至溶液 pH=7:c(Na+)═2c(SO32-)+c(HSO3-) | |
| D. | 0.1 mol AgCl 和 0.1 mol AgBr 混合后加入水中,所得溶液 c(Cl-)═c(Br-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 molFe和0.1molCu分别与0.1molCl2完全反应,转移的电子数均为0.2NA个 | |
| B. | 4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5NA | |
| C. | 1 mol FeCl3 水解生成的Fe(OH)3胶粒数为NA | |
| D. | 64 g SO2与过量的O2在一定条件下反应生成的SO3分子数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为补充土壤中的钾元素,可在田间焚烧秸秆 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | 石油的分馏、催化裂化、裂解等石油加工方法,其目的均为得到更多的汽油 | |
| D. | 做衣服的棉和麻灼烧有烧焦羽毛的气味 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石油裂解的目的是为了获得碳原子数少的轻质油 | |
| B. | lmol葡萄糖与足量的金属钠反应,最多可生成2.5molH2 | |
| C. | C3H8和C5Hl2一定互为同系物 | |
| D. | 油脂是食物中产生能量最高的营养物质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,3.65gHCl与1.7gNH3混合后,气体分子总数是0.2NA | |
| B. | 100g 98%的浓硫酸中含有的氧原子数目为4 NA | |
| C. | 1mol乙酸(忽略挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子 | |
| D. | 氯碱工业中,每转移2NA个电子,可以产生标况下44.8L气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、Mg2+、NO3-、Cl- | B. | Cu2+、Na+、HCO3-、Br- | ||
| C. | Na+、Fe2+、SO42-、NO3- | D. | K+、Na+、AlO2-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol CH5+(碳正离子)中含有的电子数为11NA | |
| B. | 6.8g熔融的KHSO4中含有0.1NA个阳离子 | |
| C. | 质量相等、密度不等的N2和C2H4两种气体所含的分子数均为NA | |
| D. | 室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
 ⑦Na2CO3+C6H5COOH ⑧AlCl3+KOH ⑨P+Cl2⑩Cu+HNO3;在不同条件下得到不同产物的是( )
⑦Na2CO3+C6H5COOH ⑧AlCl3+KOH ⑨P+Cl2⑩Cu+HNO3;在不同条件下得到不同产物的是( )| A. | 除⑤ | B. | 除②⑤ | C. | 除④⑥ | D. | 除④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
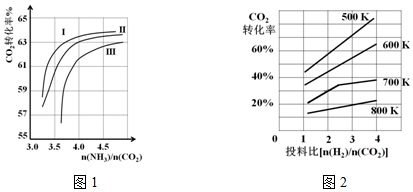
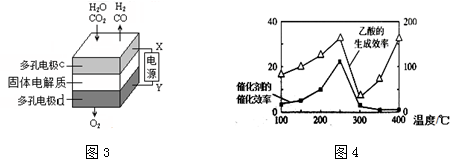
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com