
科目: 来源: 题型:选择题
| A. | 电解后,电解槽底部的阳极泥中只有金属Pt | |
| B. | 电解过程中,电解质溶液的质量可能保持不变 | |
| C. | 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ | |
| D. | 阳极发生氧化反应,其电极反应式:Ni2++2e-═Ni |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应速率VB(正)=VC(逆) | B. | B、C物质的量之比保持不变 | ||
| C. | B的体积分数不变 | D. | 混合气体的密度保持不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  验铁粉与水蒸气反应产生的氢气 | |
| B. |  分离两种互溶但沸点相差较大的液体混合物 | |
| C. |  乙酸乙酯的制备演示实验 | |
| D. |  碳酸氢钠受热分解 |
查看答案和解析>>
科目: 来源: 题型:选择题
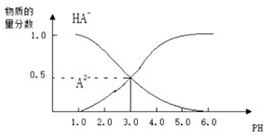 常温下,向1L0.1mol/LH2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元 素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是( )
常温下,向1L0.1mol/LH2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元 素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是( )| A. | H2A的电离方程式为:H2A?H++HA-,HA-?H++A2- | |
| B. | 0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L | |
| C. | 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后c(A2-)=c(HA-) | |
| D. | pH=4.0时,HA-电离常数为10-3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 浓、稀HNO3分别与Cu 反应 | 比较浓、稀HNO3的酸性强弱 |
| B | MgCl2、AlCl3溶液中分别加入过量NaOH溶液 | 比较镁、铝的金属性强弱 |
| C | 测定等浓度的H3PO4、H2SO4两溶液的pH大小 | 比较磷、硫的非金属性强弱 |
| D | 用等浓度的盐酸、碳酸氢钠两溶液混合反应 | 比较盐酸、碳酸的酸性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 CuSO4和Cu(NO3)2是自然界中重要的铜盐.请回答下列问题:
CuSO4和Cu(NO3)2是自然界中重要的铜盐.请回答下列问题: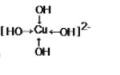 (用箭头表示出配位键的位置)
(用箭头表示出配位键的位置)查看答案和解析>>
科目: 来源: 题型:选择题
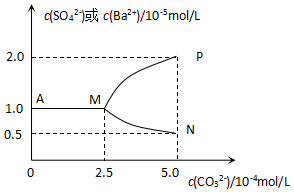 常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是| A. | 相同温度时,Ksp(BaSO4)>Ksp(BaCO3) | |
| B. | BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大 | |
| C. | 若使0.05molBaSO4全部转化为BaCO3,至少要加入1.25molNa2CO3 | |
| D. | 0.05molBaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为:c(CO32-)>c(SO42-)>c(OH-)>c(Ba2+) |
查看答案和解析>>
科目: 来源: 题型:解答题
| 热化学方程式 | 平衡常数 | |
| ① | 2NO2(g)+NaCl(s)?NaNO3(s)+NOCl(g)△H1 | K1 |
| ② | 4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 | K2 |
| ③ | 2NO(g)+Cl2(g)?2NOCl(g)△H3 | K3 |

查看答案和解析>>
科目: 来源: 题型:解答题

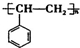 .
.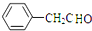 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2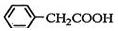 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com