
科目: 来源: 题型:选择题
| A. | 锂作为电池的负极,石墨作电池的正极 | |
| B. | 电池工作过程中,SOCl2被还原为Li2SO3 | |
| C. | 该电池内环境应该是无水环境,否则影响电池的寿命 | |
| D. | 电池工作时,锂提供的电子的物质的量与析出硫的物质的量之比是4:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有②④⑥⑦ | B. | 只有①③⑤⑦ | C. | 只有③④⑥ | D. | 只有①②⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
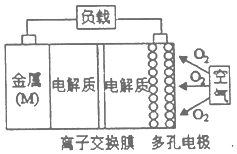 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 | |
| B. | 在Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 | |
| C. | M-空气电池放电过程的正极反应式:正极反应式为O2+2H2O+4e-═4OH- | |
| D. | 比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,5.6g Fe与含0.2mol HNO3的溶液充分作用,最少会失去电子数为0.15NA | |
| B. | 3g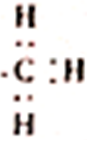 所含的电子数为1.8NA 所含的电子数为1.8NA | |
| C. | 常温下,1L 0.1mol/L AlCl3溶液中阳离子数目小于0.1NA | |
| D. | 15.6g Na2O2 和Na2S的固体混合物中,含有阴离子数目为0.3NA |
查看答案和解析>>
科目: 来源: 题型:解答题

 为该转化过程的催化剂
为该转化过程的催化剂查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等浓度的Na2CO3、NaHCO3溶液混合后:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1的氨水与0.05 mol•L-1的 H2SO4溶液等体积混合后所得溶液中:2c(NH4+)+2c(NH3•H2O)═c(SO42-) | |
| C. | Kb(NH3•H2O)=2×10-5 mol•L-1,25℃时;将m mol NH4NO3固体加入氨水得n L中性溶液,所滴加氨水的浓度约为m/(200n)mol•L-1 | |
| D. | 向0.10mol•L-1CH3COONa溶液中通入HCl至PH=4:c(CH3COOH)>c(Cl-) |
查看答案和解析>>
科目: 来源: 题型:选择题
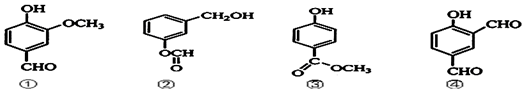
| A. | ①②③④均可与Na、NaOH、H2发生反应,1mol四种物质最多消耗Na、NaOH、H2的物质的量之比依次分别为1:1:1:1、1:2:2:1、4:3:3:5 | |
| B. | ①②③④属同分异构体,分子式为C8H8O3 | |
| C. | 可用银氨溶液或酸性KMnO4溶液区分③④ | |
| D. | ①②③④中所有原子均不可能处于同一平面 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 体积为1L、浓度为1mol/L的H2SO4和H3PO4溶液中所含氧原子数目均为4NA | |
| B. | 1molFe在71g Cl2中完全燃烧转移的电子数为3NA | |
| C. | 25℃时,pH=13的NaOH溶液中含有OH-的数目为NA | |
| D. | 25℃、101KPa下,22.4L氯气通入NaOH溶液中充分反应,转移的电子数小于NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 明矾是一种净水剂,向海水中添加明矾可以使海水淡化以解决淡水危机 | |
| B. | 工厂中常用的静电除尘装置是根据胶体带电这一性质设计的 | |
| C. | 苏轼《石炭行》中“投泥泼水愈光明”包含的化学知识:在高温下,把水滴到炭火上,得到 两种可燃性气体 | |
| D. | Si、SiO2属于半导体材料,具有导电性.Si 可用于太阳能电池板,SiO2可用于制造光导纤 维 |
查看答案和解析>>
科目: 来源: 题型:解答题
 硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤:
硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com