
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
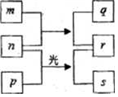 短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次増加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r 溶液的pH为2,s通常是难溶于水的液态混合物.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>Y>X | ||
| C. | W、X形成的1:1型的化合物有很多种 | D. | X的最高价氧化物的水化物为强酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:C>D>B>A | |
| B. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 | |
| C. | C与B形成的两种化合物均属于离子化合物,且化学键类型完全相同 | |
| D. | B的单质比A的单质更易与氢气化合 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 水玻璃可用于生产黏合剂和灭火剂 | |
| B. | 煤的干馏、油脂的皂化和石油的分馏都属于化学变化 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸钠 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | Zn极上发生还原反应 | |
| B. | 电子沿Zn→a→b→Cu路径流动 | |
| C. | 片刻后,乙池中c(Cu2+)减小,c(SO42-)基本不变,溶液不再保持电中性 | |
| D. | 片刻后可观察到滤纸a点变红色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K+、CO32-、AlO2- | B. | SO42-、AlO2-、K+、CO32- | ||
| C. | CO32-、K+、Al3+、NH4+ | D. | MnO4-、K+、CO32-、NH4+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,生成SO3分子数为0.2NA | |
| B. | 一定条件下,2.3g Na与O2完全反应生成3.6g产物时失去的电子数为0.1 NA | |
| C. | 25℃时,0.1 mol•L─1Na2S溶液中含有Na+的数目为0.2 NA | |
| D. | 将1mL 5.68 mol•L─1的FeCl3饱和溶液制成胶体,可得到0.00568 NA个Fe(OH)3胶粒 |
查看答案和解析>>
科目: 来源: 题型:解答题
 水是宝贵的自然资源,水的净化与污水处理是化学工作者需要研究的重要课题.
水是宝贵的自然资源,水的净化与污水处理是化学工作者需要研究的重要课题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 混合气体平均相对分子质量保持一定 | |
| B. | 单位时间内每生成3mol C的同时,生成1 mol B | |
| C. | 容器内气体密度恒定不变 | |
| D. | 反应前后容器内总压强恒定不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com