
科目: 来源: 题型:实验题
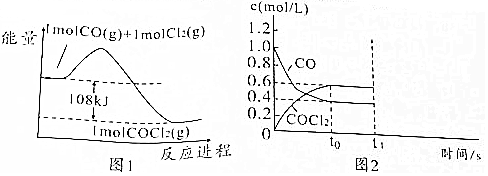
 ;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2;
;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2;查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为4.4g (假设该过程中所有液体进出口密闭) | |
| B. | b放电的电极反应式为SO32-+H2O-e-═SO42-+2H+ | |
| C. | 电子由a经内电路流向b电极 | |
| D. | 图中b极连接电源的正极,C 口流出的物质是亚硫酸 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 700 | 700 | 750 |
| 达平衡时间/min | 40 | 5 | 30 |
| n(D)平衡/mol | 1.5 | 1.5 | 1 |
| 化学平衡常数 | K1 | K2 | K3 |
| A. | K3>K2=K1 | |
| B. | 实验Ⅱ可能使用了催化剂 | |
| C. | 实验Ⅲ达平衡后容器内的压强是实验Ⅰ的$\frac{9}{10}$倍 | |
| D. | 实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡不移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )
常温下用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )| A. | 曲线I和曲线II分别代表的是CH3COOH和HCN | |
| B. | 点③和点⑤所示溶液中由水电离出的c(H+):⑤>③ | |
| C. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) | |
| D. | 在点②和③之间(不包括端点)存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) (A-代表溶液中的酸根离子) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{c(b-a)}{b}$ | B. | $\frac{c(b-a+1)}{b}$ | C. | $\frac{b-a+1}{a•b}$ | D. | $\frac{c(b-a-1)}{b}$ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
 某同学设计如图所示装置,用电解法把Na2CrO4溶液转变为Na2Cr2O7溶液(2CrO42-+2H+═Cr2O72-+H2O).下列说法正确的是( )
某同学设计如图所示装置,用电解法把Na2CrO4溶液转变为Na2Cr2O7溶液(2CrO42-+2H+═Cr2O72-+H2O).下列说法正确的是( )| A. | A为正极,B为负极 | |
| B. | 电解过程中,电解槽左侧溶液pH增大 | |
| C. | 电解过程中,Na+在电解槽中自左向右迁移 | |
| D. | 当电路中通过lmol电子时,阴极生成0.5mol Na2Cr2O7 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 氯化银可溶于氨水 | |
| B. | 银氨溶液中加入少量氯化钠有白色沉淀 | |
| C. | 银氨溶液中加入盐酸有白色沉淀 | |
| D. | 银氨溶液可在酸性条件下稳定存在 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 白色沉淀转化为红褐色沉淀的离子方程式是:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3 | |
| B. | 上述实验说明:Mg(OH)2的KSP大于Fe(OH)3的KSP | |
| C. | 最后所得溶液中:c (Cl-)=c (NH4+)+2c (Mg2+)+3c (Fe3+) | |
| D. | 最后所得溶液中:c (Cl-)>c (NH4+)>c (Mg2+)>c (Fe3+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com