
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
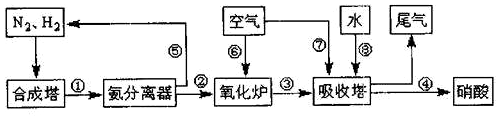

查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,pH=3的醋酸和pH=11的NaOH溶液等体积混合后,溶液的pH<7 | |
| B. | 1mL浓氨水加水稀释至100 mL后,溶液中n(OH-)减少 | |
| C. | NaHCO3完全分解后的固体溶于水,所得溶液中不存在HCO3- | |
| D. | 常温下,向NH4Cl溶液中加入氨水至溶液的pH=7,此时溶液中c(NH4+)>c(Cl-) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用正催化剂能加大反应速率 | |
| B. | 改变反应物的压强对反应速率产生影响 | |
| C. | 冬天气温低,反应速率降低,对人体危害更大 | |
| D. | 无论外界条件怎样改变,均对此化学反应的速率无影响 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH2=CHCH3与HBr | B. |  与NaOH乙醇溶液共热 与NaOH乙醇溶液共热 | ||
| C. | CH3CH3与 Cl2 | D. |  与NaHCO3溶液 与NaHCO3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在水中的溶解性:NaHCO3<Na2CO3 | |
| B. | 相同条件下,与等浓度盐酸反应生成CO2的速率:Na2CO3<NaHCO3 | |
| C. | 等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应产生的CO2质量相同 | |
| D. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,Na2CO3放出CO2更多 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.3 | 9.7 |
| Fe3+ | 1.4 | 3.2 |
| Zri2+ | 6.2 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com