
科目: 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 25 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 20 | 0.152 |

查看答案和解析>>
科目: 来源: 题型:实验题

| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目: 来源: 题型:解答题
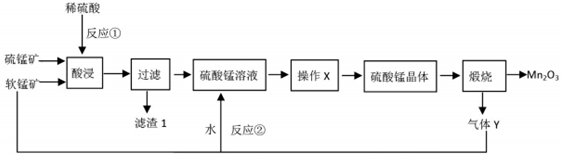
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 肥皂水、氢氧化铁胶体均属于胶体 | |
| B. | 胶体区分于其他分散系的本质特征是分散质粒子直径大小在1-100nm之间 | |
| C. | 用平行光照射NaCl溶液和Fe(OH)3胶体时,产生现象相同 | |
| D. | Fe(OH)3胶体能够使水中悬浮物的固体颗粒沉降,达到净水的目的 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②③④ | C. | ①③④ | D. | ①②⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
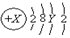 ,则X、Y及该原子3d能级上的电子数不可能的组合是( )
,则X、Y及该原子3d能级上的电子数不可能的组合是( )| A. | 18、8、0 | B. | 20、8、0 | C. | 25、13、5 | D. | 30、18、10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com