
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 容器 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化/kJ | ||
| N2 | H2 | NH3 | |||
| a | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
| b | 2 | 8 | 0 | t2 min | 放出热量:Q |

查看答案和解析>>
科目: 来源: 题型:解答题
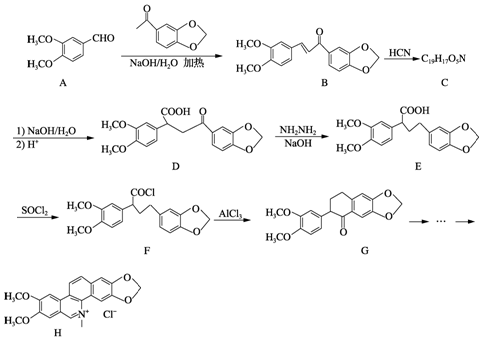
 ;由E→F的反应类型为取代.
;由E→F的反应类型为取代. .
. ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
科目: 来源: 题型:推断题


 .
. .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题

 )
)
 .由甲苯生成甲的反应类型是取代反应.
.由甲苯生成甲的反应类型是取代反应. +HOCH2CH2Cl$→_{△}^{浓硫酸}$
+HOCH2CH2Cl$→_{△}^{浓硫酸}$ +H2O
+H2O .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加成反应、取代反应 | B. | 加成反应、消去反应 | ||
| C. | 取代反应、消去反应 | D. | 取代反应、加成反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 |
| A. | 等物质的量浓度的各溶液pH关系:pH(Na2CO3)>pH(CH3COONa)>pH(NaCN) | |
| B. | NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)c+(CO32-)+c(OH-) | |
| C. | 向PH=1的醋酸溶液中加水稀释,醋酸的电离度、pH均先增大后减小 | |
| D. | a mol•L-1HCN溶液与b mol•L-1NaOH溶液等体积混合,若pH=7,则a>b |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲中沉淀一定比乙多 | B. | 甲和乙中沉淀可能一样多 | ||
| C. | 甲中沉淀可能比乙多 | D. | 乙中沉淀一定比甲多 |
查看答案和解析>>
科目: 来源: 题型:选择题
 化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示.下列说法不正确的是 (相对原子质量 O-16)( )
化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示.下列说法不正确的是 (相对原子质量 O-16)( )| A. | A为电源的正极 | |
| B. | 溶液中H+从阳极向阴极迁移 | |
| C. | Ag-Pt电极的电极反应式为2NO3-+12H++10e-═N2↑+6H2O | |
| D. | 电解过程中,每转移2 mol电子,则左侧电极就产生32gO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
 ,下列有关该有机物说法正确的是( )
,下列有关该有机物说法正确的是( )| A. | 该有机物的化学式为C10H14 | |
| B. | 它的一氯代物有6种 | |
| C. | 它的分子中所有的碳原子一定在同一平面上 | |
| D. | 一定条件下,它可以发生取代、加成、氧化和还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com