
科目: 来源: 题型:选择题
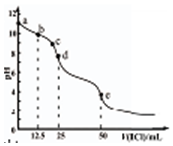 常温下,用0.1000mol/L 的盐酸滴定0.1000mol/L Na2CO3溶液25.00mL.用pH传感器测得混合溶液的pH变化曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L 的盐酸滴定0.1000mol/L Na2CO3溶液25.00mL.用pH传感器测得混合溶液的pH变化曲线如图.下列说法正确的是( )| A. | c→d发生的主要离子反应:HCO3-+H+═H2O+CO2 | |
| B. | 在b点 时,c(HCO3-)>c(CO32-)>c(OH-) | |
| C. | 在d点 时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| D. | 在e点 时完全反应后溶液中水电离出c(H+)=1.0×10-7mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
 以熔融CaF2-CaO作电解质,用下图所示袋置获得金属钙,并用钙还原TiO2制备金属钛.下列说法正确的是( )
以熔融CaF2-CaO作电解质,用下图所示袋置获得金属钙,并用钙还原TiO2制备金属钛.下列说法正确的是( )| A. | 整套装置工作前后中CaO的总量基本不变 | |
| B. | 阳极的电极反应式为2Ca2++4e-=2Ca | |
| C. | 石墨电极作阳极,质量不变 | |
| D. | 电解过程中,F-和O2-向阴极移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
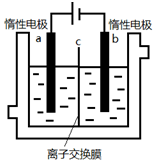 加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法正确的是( )
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法正确的是( )| A. | b电极是负极 | |
| B. | 装置中的离子交换膜是阳离子交换膜 | |
| C. | 阳极电极反应:4OH--4e-═2H2O+O2↑ | |
| D. | a极区的KI最终转变为KIO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
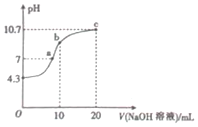 连二次硝酸(H2N2O2)是一种二元酸,常温下,用0.01mol•L-1的NaOH溶液滴定10mL0.01mol•L-1 H2N2O2溶液,溶液pH随加入NaOH溶液体积的变化如图所示,下列有关说法中正确的是( )
连二次硝酸(H2N2O2)是一种二元酸,常温下,用0.01mol•L-1的NaOH溶液滴定10mL0.01mol•L-1 H2N2O2溶液,溶液pH随加入NaOH溶液体积的变化如图所示,下列有关说法中正确的是( )| A. | H2N2O2在水溶液中的电离方程式为H2N2O2═2H++N2O22- | |
| B. | 该滴定过程应该选择甲基橙作为指示剂 | |
| C. | a点的溶液中:c(Na+)+c(H+)═c(OH-)+c(N2O22-)+c(H N2O2-) | |
| D. | b点的溶液中:c(Na+)>c(H N2O2-)>c(OH-)>c(H2N2O2)>c(N2O22-) |
查看答案和解析>>
科目: 来源: 题型:选择题
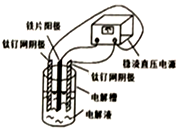 电镀产生的工业废水含有的重金属离子(Cu2+、Ni2+等)和CN形成难以除去的络合物,用电解法制备高铁酸钠(Na2FeO4)处理废水是目前比较先进的方法.已知氰化氢有毒易挥发.电解装置如图所示,下列选项正确的是( )
电镀产生的工业废水含有的重金属离子(Cu2+、Ni2+等)和CN形成难以除去的络合物,用电解法制备高铁酸钠(Na2FeO4)处理废水是目前比较先进的方法.已知氰化氢有毒易挥发.电解装置如图所示,下列选项正确的是( )| A. | 铁片连接电源的负极 | |
| B. | 电解时,每生成lmolFeO42-,转移电子3mol | |
| C. | CN被氧化成CO2和N2,Cu2+、Ni2+形成难溶碱而除去 | |
| D. | 已知HFeO4-的氧化性比FeO42-更强,故pH<7时处理废水效率更高 |
查看答案和解析>>
科目: 来源: 题型:解答题
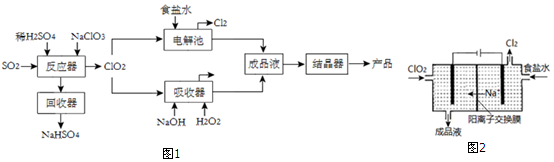
查看答案和解析>>
科目: 来源: 题型:解答题
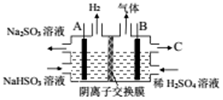 燃煤烟气脱硫有很多方法
燃煤烟气脱硫有很多方法查看答案和解析>>
科目: 来源: 题型:选择题
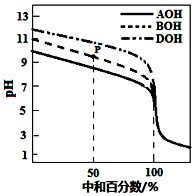 室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol•L-1的三种碱(AOH、BOH和DOH)溶液,滴定的曲线如图所示,下列判断正确的是( )
室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol•L-1的三种碱(AOH、BOH和DOH)溶液,滴定的曲线如图所示,下列判断正确的是( )| A. | 滴定时,随着盐酸溶液的滴入,水电离出的c(H+)始终增大 | |
| B. | 滴定至P点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+) | |
| C. | pH=7时,三种溶液中c(Cl-) 相等 | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(NO)/mol•L-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-3 | 1.50×10-3 | 1.50×10-3 |
| c(CO)/mol•L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
查看答案和解析>>
科目: 来源: 题型:选择题
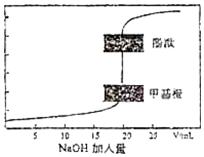 常温下,用0.1000mol•L-1的NaOH标准溶液滴定20.00mL0.1000mol•L-1的HCl溶液,滴定曲线如图,下列有关说法正确的是( )
常温下,用0.1000mol•L-1的NaOH标准溶液滴定20.00mL0.1000mol•L-1的HCl溶液,滴定曲线如图,下列有关说法正确的是( )| A. | 指示剂变色时,说明反应的酸、碱恰好等物质的量反应 | |
| B. | 当达到滴定终点时才存在c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 达到滴定终点时,用甲基橙作指示剂消耗NaOH溶液体积比用酚酞多 | |
| D. | 己知 H+(aq)+OH- (aq)=H2O(l)△H=-57.3 kJ/mol,上述滴定恰好中和时,放出114.6 J的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com