
科目: 来源: 题型:选择题
| A. | 若两种烃中碳元素的质量分数相同,则最简式必然相同 | |
| B. | CH2═CH2和CH2═CH-CH═CH2互为同系物 | |
| C. |  互为同分异构体 互为同分异构体 | |
| D. | 同分异构体的化学性质一定相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
 298K时,向体积均为15mL、浓度均为1.00mol•L-1的氨水和NaHCO3溶液中分别滴加l.00mol•L-1的盐酸,溶液的pH与所加盐酸体积的关系如图所示.下列有关叙述正确的是( )
298K时,向体积均为15mL、浓度均为1.00mol•L-1的氨水和NaHCO3溶液中分别滴加l.00mol•L-1的盐酸,溶液的pH与所加盐酸体积的关系如图所示.下列有关叙述正确的是( )| A. | 当V(盐酸)=4.00mL时,c(HCO3-)>c(NH4+)>c(CO32-) | |
| B. | 两个滴定过程均可选择酚酞作指示剂 | |
| C. | 曲线a是NaHCO3溶液的滴定曲线 | |
| D. | 当V(盐酸)=15.00mL时,c(Na+)═c(NH4+) |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,基态f原子的核外电子排布式为1s22s22p63s23p63d104s1.
,基态f原子的核外电子排布式为1s22s22p63s23p63d104s1.
查看答案和解析>>
科目: 来源: 题型:解答题
 工业上“固定”和利用CO2能有效地减轻“温室效应”.
工业上“固定”和利用CO2能有效地减轻“温室效应”.| 物质的化学式 | CH3COOH | HCO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:选择题
 下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有 K+、Fe3+、Cu2+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子,该小组同学取 100mL 水样进行实验:向样品中先滴加氯化钡溶液,再滴加 1mol•L-1 盐酸,实验过程中沉淀质量的变化如图所示.下列说法正确的是( )
下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有 K+、Fe3+、Cu2+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子,该小组同学取 100mL 水样进行实验:向样品中先滴加氯化钡溶液,再滴加 1mol•L-1 盐酸,实验过程中沉淀质量的变化如图所示.下列说法正确的是( )| A. | 水样中一定不存在Fe3+、Cu2+,可能存在Ag+ | |
| B. | 水样中一定存在CO32-、SO42-、Cl- | |
| C. | BC段曲线所表示的离子方程式为CO32-+2H+=H2O+CO2↑ | |
| D. | 水样中一定存在K+,且c(K+)≥0.6mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题

 .如果没有步骤③,D、F能反应吗?能.
.如果没有步骤③,D、F能反应吗?能. .
.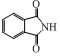 为原料,写出制备
为原料,写出制备 的合成路线流程图(无机试剂任用).CH≡CH$→_{催化剂}^{H_{2}O}$
的合成路线流程图(无机试剂任用).CH≡CH$→_{催化剂}^{H_{2}O}$ →
→ .
.查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y |
| Z | W |
| A. | 若四种元家均为金属,则Z的最高价氧化物对应水化物一定为强碱 | |
| B. | 若四种元素均为非金属,则W的最高价氧化物对应水化物一定为强酸 | |
| C. | 若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数) | |
| D. | 若四种元素只有一种为金属,则Z与Y两者的最高价氧化物对应水化物能反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
浓度/mol/L 时间/min | 0 | 10 | 20 | 30 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 |
| N2 | 0 | 0.21 | 0.30 | 0.30 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 |

查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,向20mL的某稀盐酸中滴入0.1mol•L-1的氨水,溶液中由水电离出的氢离子浓度随滴人氨水体积的变化如图.下列分析不正确的是( )
常温下,向20mL的某稀盐酸中滴入0.1mol•L-1的氨水,溶液中由水电离出的氢离子浓度随滴人氨水体积的变化如图.下列分析不正确的是( )| A. | V2=20 mL | B. | d点溶液中:c(NH4+)>c(Cl-) | ||
| C. | b点溶液中:c(H+)=c(OH-) | D. | 该稀盐酸的浓度为0.1 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com