
科目: 来源: 题型:选择题
 已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )
已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )| A. | a线代表的是PbCO3 | |
| B. | T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+):c(Pb2+)=3×10-5 | |
| C. | d点可以代表CaCO3的饱和溶液,且c(Ca2+)=c(CO32-) | |
| D. | T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目: 来源: 题型:实验题
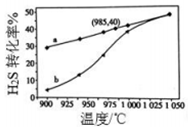 废气中的H2S通过高温热分解可制取氢气:2H2S(g)?2H2(g)+S2(g).在3L密闭容器中,控制不同温度进行H2S分解实验.
废气中的H2S通过高温热分解可制取氢气:2H2S(g)?2H2(g)+S2(g).在3L密闭容器中,控制不同温度进行H2S分解实验.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | ①浊液中存在平衡:Ag2CrO4(s)?2Ag+(aq)+CrO42-(aq) | |
| B. | ②中溶液变澄淸原因:AgOH+2NH3•H2O═[Ag(NH3)2]OH+2H2O | |
| C. | ③中顔色变化说明有AgCl生成 | |
| D. | 该实验可以证明AgCl比Ag2CrO4更难溶 |
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,向 1L 0.10mol•L-1CH3COONa 溶液中,不断通入HC1气体(忽略溶液体积变化),得到 c (CH3COO-)和c(CH3COOH)与 pH 的变化关系如下,则下列说法正确的是( )
常温下,向 1L 0.10mol•L-1CH3COONa 溶液中,不断通入HC1气体(忽略溶液体积变化),得到 c (CH3COO-)和c(CH3COOH)与 pH 的变化关系如下,则下列说法正确的是( )| A. | 溶液的pH比较:x<y<z | |
| B. | 在y点再通入0.05 mol HCl气体,溶液中离子浓度大小比较:c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点 | |
| D. | 该温度下,CH3COOH的Ka=104.75 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com