
科目: 来源: 题型:解答题

 ;
; .
. .
. .
.
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 700℃ | 900℃ | |
| K3 | 1.47 | 2.15 |
| K4 | 2.38 | 1.67 |
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
 某化学兴趣小组利用如图装置进行铝热反应实验,发现生成的铁呈疏松的褐色硬块.小组成员推测主要原因是产物铁含杂质较多,并进一步探究该褐色硬块的组成.请回答下列问题:
某化学兴趣小组利用如图装置进行铝热反应实验,发现生成的铁呈疏松的褐色硬块.小组成员推测主要原因是产物铁含杂质较多,并进一步探究该褐色硬块的组成.请回答下列问题:| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设II不成立 |
| ②再滴入几滴0.01mol/L KSCN 溶液 | 溶液不变色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | W、Q、X三种元素可以组成共价化合物和离子化合物 | |
| B. | Q的简单氢化物的热稳定性比X的强 | |
| C. | Y的简单离子与X的简单离子具有相同的电子层结构 | |
| D. | W、X、Y 三种元素形成的化合物具有离子键和共价健 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10.8g | B. | 7.2g | C. | 5.4g | D. | 3.6g |
查看答案和解析>>
科目: 来源: 题型:推断题
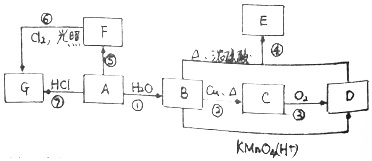
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 吸热反应是指反应物的总能量高于生成物的总能量 | |
| B. | 放热反应是指反应物的总键能高于生成物的总键能 | |
| C. | 核外电子总数相同的电中性原子,一定是同种元素的原子 | |
| D. | 二氧化氮与水反应能生成硝酸,所以二氧化氮是酸性氧化物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过量石灰水与碳酸氢钠溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| B. | 次氯酸钙溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓ | |
| C. | 向氯化铝溶液中滴加过量氨水:A13++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 15倍 | B. | 14倍 | ||
| C. | 14-16倍之间任意倍数 | D. | 16倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com