
科目: 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |


查看答案和解析>>
科目: 来源: 题型:
 (2011?武胜县一模)为了测定某碱金属M的相对原子质量,设计了如图所示的装置.仪器本身连同水的质量为m1g.若向瓶中投入ag金属M,实验完毕后,测得装置的质量为m2g.则计算碱金属M的相对原子质量的算式和实验值与正确值的比较分别是( )
(2011?武胜县一模)为了测定某碱金属M的相对原子质量,设计了如图所示的装置.仪器本身连同水的质量为m1g.若向瓶中投入ag金属M,实验完毕后,测得装置的质量为m2g.则计算碱金属M的相对原子质量的算式和实验值与正确值的比较分别是( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
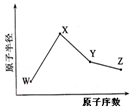 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是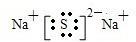
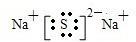
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com