
科目: 来源: 题型:选择题
| A. | 第二周期元素氢化物稳定性的顺序是:HF>H2O,所以第三周期元素氢化物稳定性 的顺序也是:HCl>H2S | |
| B. | ⅣA 族元素氢化物熔点顺序是:SiH4>CH4,所以ⅤA 族元素氢化物熔点顺序也 是:PH3>NH3 | |
| C. | ⅦA 族元素的非金属性是:F>Cl,所以ⅦA 族元素氢化物的酸性也是:HF>HCl | |
| D. | ⅤA 族元素最高价氧化物对应水化物化学式均表示为 HXO3,从上至下,酸性减弱 |
查看答案和解析>>
科目: 来源: 题型:解答题

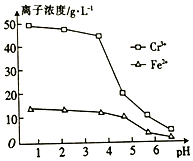
查看答案和解析>>
科目: 来源: 题型:解答题
 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | NO中的氮氧键 | Cl-Cl键 | Cl-N键 | ClNO中的N=O键 |
| 键能/(KJ/mol) | 630 | 243 | a | 607 |
| 序数 | c(ClNO)/(mol/L) | v/(mol•L•s) |
| ① | 0.30 | 3.60×10-9 |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 砹是一种有色固体,它的气态氢化物很不稳定 | |
| B. | 溴化氢比氯化氢稳定,HClO4酸性强于HBrO4 | |
| C. | 铷的硫酸盐易溶解于水,其氢氧化物一定是强碱 | |
| D. | F2与水反应比Cl2与水反应剧烈 |
查看答案和解析>>
科目: 来源: 题型:选择题
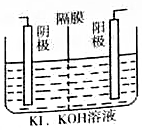 KIO2是食用碘盐的添加剂,工业上制取KIO2的方法之一如图所示,其中阳(阴)离子隔膜只允许阳(阴)离子通过,下列有关说法中正确的是( )
KIO2是食用碘盐的添加剂,工业上制取KIO2的方法之一如图所示,其中阳(阴)离子隔膜只允许阳(阴)离子通过,下列有关说法中正确的是( )| A. | 可用铁作阳极、石墨作阴极 | |
| B. | 装置中的隔膜为阳离子隔膜 | |
| C. | 当外电路中通过2 mole-时,阴极上会有22.4LH2生成 | |
| D. | 阳极电极反应式为:I--6e-+6OH-=IO2-+3H2O |
查看答案和解析>>
科目: 来源: 题型:解答题

| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 2.6×10-39 |
查看答案和解析>>
科目: 来源: 题型:解答题
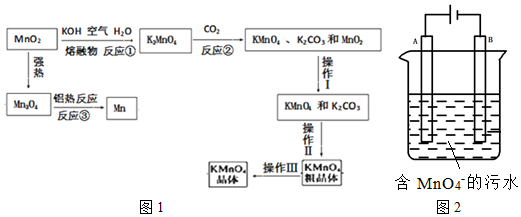
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:| 化学键 | H-H | O-H | C-H |  |
| E/(kJ•mol-1) | 436 | 465 | 413 | 1076 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com